四川省成都市蓉城名校联盟2022届高三下学期第三次联考理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
中华诗词中蕴含着丰富的化学知识。下列关于诗词的分析错误的是( )
A . “ 蜡烛有心还惜别,替人垂泪到天明”,句中蜡烛变化过程只涉及物理变化
B . “梨花院落溶溶月, 柳絮池塘淡淡风”,句中柳絮的主要成分属于糖类
C . “遍身罗绮者,不是养蚕人”,句中的罗绮不可用沸水浸泡
D . “炉火照天地,红星乱紫烟”,句中情境描述了金属的冶炼过程
|
|
| 2. 单选题 | |
|
下列关于有机化合物
A . 可以发生加成反应、取代反应和氧化反应
B . 分子中所有原子一定共平面
C . 苯环上的一氯代物有2种
D . 1mol该化合物最多能消耗2molNa
|
|
| 3. 单选题 | |
|
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A . 17g-OH 中含有的电子数为10 NA
B . 22.4L Cl2溶于水,转移的电子数为NA
C . 6.2gP4 (
 )中的共价键数目为0.3NA
D . 100 g质量分数为46%的乙醇溶液中含有的H原子数为6NA )中的共价键数目为0.3NA
D . 100 g质量分数为46%的乙醇溶液中含有的H原子数为6NA
|
|
| 4. 单选题 | |
|
W、X、Y、Z为原子序数依次增大的短周期主族元素,W元素可形成密度最小的气体单质; W和Y的最外层电子数相同,可形成离子化合物YW;常温下0.01mol·L-1 X、Z的最高价氧化物对应的水化物溶液的pH值均为2,下列叙述错误的是( )
A . 原子半径:Y>Z> W
B . X、Z分别与W形成的简单化合物相遇会产生白烟
C . XZ3分子中,所有原子的最外层均满足8电子稳定结构
D . W、X和Z形成的化合物中只含有共价键
|
|
| 5. 单选题 | ||||||||||||||||
|
下列实验操作所对应的现象正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 6. 单选题 | |
|
水系钠离子电池在可再生能源规模储存领域具有重要应用前景。下图为水系钠离子电池的工作原理,工作时的总反应为: Na2Ni[Fe(CN)6] + NaTi2(PO4)3
 Na2+xNi[Fe(CN)6] +Na1-xTi2(PO4)3 , 在放电过程中,电极表面会发生电解液析氢副反应,可添加MgSO4溶液来保护电极。下列说法错误的是( ) Na2+xNi[Fe(CN)6] +Na1-xTi2(PO4)3 , 在放电过程中,电极表面会发生电解液析氢副反应,可添加MgSO4溶液来保护电极。下列说法错误的是( )
A . 放电时,
 向 Y电极移动
B . 正极的电极反应式为Na2Ni[Fe(CN)6]+ xe- + xNa+ = Na2+xNi[Fe(CN)6]
C . 充电时,X电极与电源负极相连
D . Mg2+结合水电解出的OH-生成Mg(OH)2保护层附着在电极表面,可增强材料的耐腐蚀能力 向 Y电极移动
B . 正极的电极反应式为Na2Ni[Fe(CN)6]+ xe- + xNa+ = Na2+xNi[Fe(CN)6]
C . 充电时,X电极与电源负极相连
D . Mg2+结合水电解出的OH-生成Mg(OH)2保护层附着在电极表面,可增强材料的耐腐蚀能力
|
|
| 7. 单选题 | |
|
常温下,向某浓度的二元弱酸H2X溶液中逐滴加入NaOH稀溶液,所得溶液中三种微粒H2X、HX-、X2-的物质的量分数(δ)与溶液pH的关系如图所示。下列叙述错误的是( )
A . M →A反应的离子方程式为: H2X+OH- = HX- + H2O
B . B点的溶液中: c(Na+)> 3c(X2-)
C . NaHX溶液中: c(OH-)+ c(X2-)= c(H+) + c(H2X)
D . 外界条件不变时,加入NaOH稀溶液的过程中,
 =10, 且始终保持不变 =10, 且始终保持不变
|
|
| 8. 实验探究题 | |||||||||||||||||||||
|
二氯化硫(SCl2)是一种重要的化工原料, 被广泛用作有机合成的氯化剂和润滑油的处理剂。工业上的合成方法之一是:
①2S(s) + Cl2(g) ②S2Cl2(l)+ Cl2(g) = 2SCl2(l)。 已知相关物质的性质如下表所示:
某小组在实验室模拟工业制备二氯化硫时设计了如下实验装置(部分夹持装置已略去) 。
回答下列问题:
|
|||||||||||||||||||||
| 9. 综合题 | |
|
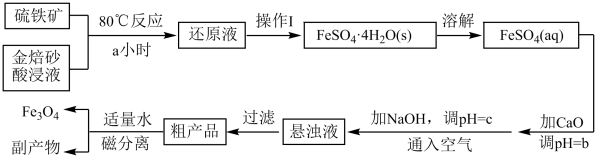
工业上以金焙砂酸浸液(主要成分为Fe2(SO4)3和FeSO4 , 忽略其它杂质)与硫铁矿(主要成分为FeS2 , 忽略其它杂质)为原料制备Fe3O4的流程如下:
回答下列问题:
|
|
| 10. 综合题 | ||||||||||||||||||||||
|
我国提出力争在2030年前实现碳达峰,2060 年前实现碳中和。“双碳”战略倡导绿色、低碳的生产生活方式,加快降低碳排放的步伐,有利于引导绿色技术创新发展。
|
||||||||||||||||||||||
- 福建省永泰县第一中学2018-2019学年高二上学期化学期末考试试卷
- 2016-2017学年江西省吉安三中高三上学期期中化学试卷
- 安徽省颍上三校联考2019-2020学年高三上学期化学第一次月考试卷
- 江苏省扬州市2019-2020学年高二学业水平合格性考试模拟试卷(二)
- 辽宁省重点高中协作校2017-2018学年高考理综-化学二模考试试卷
- 河北省2020年高考理综-化学模拟试卷(全国Ⅰ卷)
- 吉林省五地六市联盟2018-2019学年高一下学期化学期末考试试卷
- 2015-2016学年江苏省苏州市高一上学期期末化学试卷
- 安徽省蚌埠市2018-2019学年高考化学一模考试试卷
- 高中化学人教版(新课标)选修4 第一章测试卷
- 内蒙古包头市北重三中2016-2017学年高一下学期化学期末考试试卷(文科)
- 2016年江西省宜春四中高考化学一模试卷


 S2Cl2(l);
S2Cl2(l);
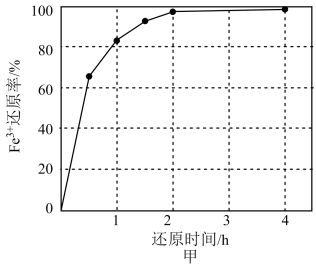
 的关系如图乙所示,则调pH为c=(填具体值),向调pH后的溶液中通入空气的目的是。
的关系如图乙所示,则调pH为c=(填具体值),向调pH后的溶液中通入空气的目的是。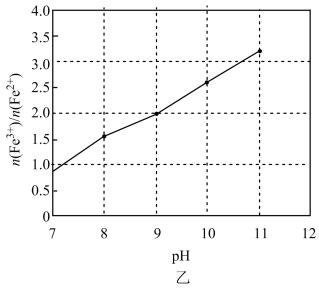
 CO(g) + H2O(g),化学平衡常数K与温度T的关系如下表所示:
CO(g) + H2O(g),化学平衡常数K与温度T的关系如下表所示:


