四川省泸州市2022届高三下学期第三次教学质量诊断性考试理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活密切相关,下列说法错误的是( )
A . 部分天然的纤维素和蛋白质可用于制作服装的原料
B . 日常生活中常见氯化钠可作为廉价的食品防腐剂
C . 开窗通风可降低室内装修材料释放到空气中的氡气含量
D . 汽车尾气中的氮氧化物是汽油不完全燃烧的产物
|
|
| 2. 单选题 | |
|
中药莪术有行气破血,消积止痛之功效,莪术二醇是莪术挥发油主要成分之一,其结构简式如图。下列说法错误的是( )
A . 莪术二醇的分子式为C15H26O2
B . 莪术二醇可以使酸性K2Cr2O7溶液变色
C . 莪术二醇含有两个醇羟基可以催化氧化得到二元醛
D . 一定条件下莪术二醇可发生加聚反应得到高聚物
|
|
| 3. 单选题 | |
|
NA表示阿伏加德罗常数,下列说法正确的是( )
A . 光照下足量甲烷使1mol Cl2完全反应,有机物中Cl原子数为NA
B . 含46g CH3CH2OH的酒精水溶液中含有的H原子数为6NA
C . 1mol Na2O2中含离子键与共价键数均为NA
D . FeCl3溶液与KSCN溶液均为1L 0.1mol/L,混合后生成[Fe(SCN)]2+离子数为0.1NA
|
|
| 4. 单选题 | |
|
2020年12月17日凌晨,嫦娥五号返回器携带月球样品返回地球。月壤元素X、Y、Z和M均属于短周期主族元素,其原子序数依次增大。X与Z同主族,Y、Z和M同周期。Y在短周期中原子半径最大,淡黄色的M单质常出现在地球火山口附近。四种元素的最外层电子数之和为15。下列说法正确的是( )
A . 简单氢化物热稳定性: X>Z,且都比NH3弱
B . 最高价氧化物的熔点: M>Z>X
C . 与M同周期相邻的元素的最高价含氧酸均为强酸
D . 含Y和M的简单化合物中阴阳离子半径之比小于1
|
|
| 5. 单选题 | ||||||||||||||||
|
下列物质的除杂实验中,不能实现除杂目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 6. 单选题 | |
|
含有硝酸盐和亚硝酸盐的酸性废水可导致水体富营养化,引发环境污染。如图是利用电化学原理处理
 的原理。下列有关叙述错误的是( ) 的原理。下列有关叙述错误的是( )
A . 直流电源为铅蓄电池时,Pb 极连接Y电极
B . 电势:X极高于Y极
C . 当产生14g N2时,有6mol H+跨膜而过
D . 阳极电极反应方程式为2H2O- 4e- =O2↑+4H+
|
|
| 7. 单选题 | |
|
常温下,用0.1mol/L盐酸滴定25.00mL 0.1mol/L弱碱MOH溶液,溶液中pH、分布系数δ随滴加盐酸体积[V(盐酸)]的变化关系如图所示。[如δ(M+)=
 ]。 下列叙述错误的是( ) ]。 下列叙述错误的是( )
下列叙述错误的是
A . 曲线①代表δ(M+),曲线③代表δ(MOH)
B .
 = 1.0 ×10-5.1
C . 点a溶液中c(M+)+c(MOH)> 2c(Cl-)
D . 图中V1> 12.5mL = 1.0 ×10-5.1
C . 点a溶液中c(M+)+c(MOH)> 2c(Cl-)
D . 图中V1> 12.5mL
|
|
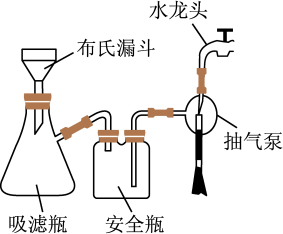
| 8. 实验探究题 | |
|
化工原料K2([Cu(C2O4)2]·2H2O(二草酸合铜酸钾晶体)为蓝色针状或絮状沉淀,某校同学设计实验制备K2([Cu(C2O4)2]·2H2O,并进行性质探究。
已知: Cu(OH)2分解温度为80℃; Cu2O 为红色。 回答下列相关问题:
|
|
| 9. 综合题 | ||||||||||||||||||||||||||||||||||||||||||||||||
|
硫酸锰铵[(NH4)2Mn(SO4)2]可用于木材防火涂料,易溶于水。用软锰矿(主要含MnO2 , 还含有Fe、Cu、Mg、 Si 元素的氧化物或盐)制备硫酸锰铵的工艺流程如下:
已知:①MgSO4和MnSO4的溶解度表如下:
②常温下,0.1mol/L 金属离子以氢氧化物形式沉淀时溶液的pH如下:
回答下列问题:
|
||||||||||||||||||||||||||||||||||||||||||||||||
| 10. 综合题 | |||||||||||||||||||||||||||||||||||
|
水煤气变换反应CO(g)+H2O(g)
 CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。 CO2 (g)+H2(g) ΔH<0 (简称WGS),在金属催化剂Au(III)表面上发生的所有基元反应步骤的活化能数值(单位: kJ/mol)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
|
|||||||||||||||||||||||||||||||||||
- 人教版高中化学选修五 第四章 第一节 油 脂 同步练习
- 2016-2017学年福建省泉州市惠南中学高一上学期期中化学试卷
- 新疆维吾尔自治区生产建设兵团第一师高级中学2018-2019学年高一上学期化学期末考试试卷
- 2015-2016学年陕西省宝鸡市金台区高一下学期期中化学试卷
- 2020高考化学常考知识点专练 06:电池
- 2016-2017学年江西省宜春三中高二上学期期中化学试卷
- 人教高中化学一轮复习:专题5常见的金属元素
- 2015-2016学年山东省枣庄市滕州十一中高三上学期期末化学模拟试卷(四)
- 备考2018年高考化学一轮基础复习:专题32 定量实验和化学实验的设计与评价
- 2015-2016学年江苏省徐州市高二上学期期末化学试卷
- 广东省惠州市2018-2019学年高考化学4月模拟考试试卷
- 2016-2017学年福建省龙岩市四校联考高二上学期期中化学试卷