河南省新乡市2021-2022学年高二上学期期中考试化学试题
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
在
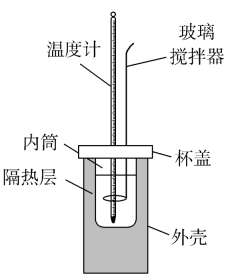
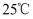 、 、 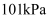 下,下列热化学方程式中 下,下列热化学方程式中  能表示有关物质燃烧热的是( ) 能表示有关物质燃烧热的是( )
A .
 B .
B . 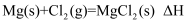 C .
C .  D .
D . 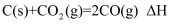
|
|
| 2. 单选题 | |
|
对于反应
  , 在任何温度下可自发进行的原因是( ) , 在任何温度下可自发进行的原因是( )
A .
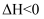 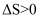 B .
B . 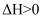 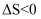 C .
C . 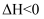 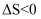 D .
D . 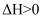 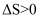
|
|
| 3. 单选题 | |
|
古籍中记载:阳遂金也,取金孟无缘者,执日高三四丈时,以向,持燥艾承之寸馀,有顷焦之,吹之则燃得火。上述记载中是古人对哪种能量的利用( )
A . 风能
B . 水能
C . 太阳能
D . 地热能
|
|
| 4. 单选题 | |
|
在一密闭容器中存在反应:
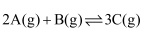 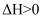 K正。某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) K正。某研究小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
A . 图Ⅰ中t时刻改变的条件一定是升高温度
B . 图Ⅱ中t时刻改变的条件一定是加入催化剂
C . 图Ⅲ中甲和乙改变的条件是温度,且乙的温度更高
D . 图Ⅳ中
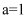
|
|
| 5. 单选题 | |
|
已知:3Cl2 +2NH3=N2 +6HCl。若反应速率分别用v(Cl2)、v(NH3) 、v(N2)、v(HCl)表示,则下列关系式正确的是( )
A .
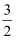 v(Cl2)= v(NH3)
B . v(Cl2)= v(NH3)
B .  v (Cl2)=v (N2)
C . v (Cl2)=v (N2)
C . 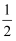 v(Cl2) = v(HCl)
D . v(Cl2) = v(HCl)
D .  v(NH3)=v(HCl) v(NH3)=v(HCl)
|
|
| 6. 单选题 | |
|
某反应过程中的能量变化如图所示,下列热化学方程式正确的是( )
A .
  B .
B .   C .
C .   D .
D .  
|
|
| 7. 单选题 | |
|
已知反应
 在不同条件下的化学反应速率如下,其中表示反应速率最快的是( ) 在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A .
 B .
B .  C .
C .  D .
D . 
|
|
| 8. 实验探究题 | ||||||||||||||||||||||||||||||||||||||||||||||
|
某化学兴趣小组进行了实验:向2支试管中分别加入0.5gNa2CO3固体和0.5gNaHCO3固体,再分别加入30mL0.3mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO
 (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题: (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
|
||||||||||||||||||||||||||||||||||||||||||||||
| 9. 综合题 | |||||||||||
|
已知下列两个反应:
反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1 反应II:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2 反应I的化学平衡常数K1与温度的关系如下表所示:
请回答下列问题:
|
|||||||||||
| 10. 单选题 | |
|
下列反应中,反应体系的焓增大且有电子转移的是( )
A . 氧化钙与水的反应
B . 过氧化氢的分解反应
C . 金属钠和稀硫酸的反应
D . 碳与二氧化碳的反应
|
|
- 广东省揭阳市2017-2018学年高二下学期化学期末考试试卷
- 江苏省扬州市2018-2019学年高二下学期化学期末考试试卷
- 江苏省无锡市普通高中2017-2018学年高二上学期化学期末考试试卷
- 专题27:苯、芳香烃
- 2016-2017学年湖北省四地七校高二下学期期中化学试卷
- 山东省德州市2017-2018学年高一下学期化学期末考试试卷
- 备考2018年高考化学一轮基础复习:专题24 水的电离和溶液的酸碱性
- 2019年高考化学真题分类汇编专题04:元素周期表及周期律
- 2015-2016学年浙江省温州市平阳二中高一上学期期中化学试卷
- 2020高考化学常考知识点专练 10:流程题
- 宁夏吴忠市吴忠中学2018-2019学年高一上学期化学期末模拟试卷
- 云南省玉溪一中2018-2019学年高一上学期化学期末考试试卷