课题2 溶解度 知识点题库
在25℃时,向饱和的澄清石灰水中加入少量氧化钙,恢复到25℃时,关于该溶液说法中正确的是( )
A . 溶质质量不变
B . 溶质质量减少
C . 溶质的质量分数减小
D . 溶质的质量分数增大
KCl与KNO3在不同温度时的溶解度数据如表,则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A . KNO3的溶解度大于KCl的溶解度
B . 两物质溶解度相等的温度在20~30℃之间
C . 在30℃时,5gKNO3加入到10g水中可得到33.3%的KNO3溶液
D . 在50℃时,两物质各10g分别加入20g水中,充分溶解,均没有固体剩余
右图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )

A . t2℃时,甲、乙两种溶液的溶质质量分数相等
B . 甲、乙、丙三种物质的不饱和溶液降温都会转化成饱和溶液
C . t3℃时,分别将甲、乙、丙三种物质的饱和溶液降温到t1℃,析出晶体最多的是甲
D . 若物质甲中含有少量的物质乙时,可用冷却结晶法获得较纯的物质甲
根据要求填空:
-
(1) 硫在氧气中燃烧的化学方程式为,该反应属于反应.
-
(2) 检验某无色无味气体是否为氧气的方法是
-
(3) 将CO2通入紫色石蕊试液中,溶液呈色.
-
(4) 使接近饱和的硝酸钾溶液变成饱和溶液的两种方法是:①②
-
(5) 在“粗盐中难容杂质的去除”实验中,实验步骤是:溶解、、蒸发、计算产率.其中,在溶解粗盐时玻璃棒的作用是.
Ca(OH)2在不同温度时的溶解度如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 0.18 | 0.16 | 0.14 | 0.11 | 0.09 |
根据表中信息,判断下列说法正确的是( )
A . Ca(OH)2的溶解度随温度的升高而增大
B . 20℃时,Ca(OH)2的溶解度为0.16g
C . 40℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D . 60℃时,向100g水中加入0.20g Ca(OH)2充分搅拌,固体完全溶解
如图是硝酸钾和氯化钠的溶解度曲线,请回答:

-
(1) 50℃时,100g水中最多可以溶解g硝酸钾。
-
(2) 20℃时,向100g水中加入30g硝酸钾固体,充分搅拌后,所得溶液为溶液(填“饱和”或“不饱和”),将该溶液升温到50℃时,其质量分数是(只列计算式)
-
(3) 欲将硝酸钾溶液从A点转化为B点,可采取的措施是。
-
(4) 20℃时,将KNO3、NaCl两种物质的饱和溶液各100g,分别恒温蒸发10g水,析出晶体最多的是(填“KNO3”或“NaCl”)。
判断下列大小或强弱关系,并用“<”、“>”或“=”填空。
-
(1) 溶解度:40℃的氢氧化钙20℃的氢氧化钙
-
(2) 热稳定性:碳酸钙碳酸氢铵;
-
(3) 相对分子质量:油脂蛋白质
-
(4) 热值:氢气甲烷
-
(5) pH:ω=10%的氯化钠溶液ω=3%的苛性钠溶液
图是A,B,C三种物质的溶解度曲线,下列分析错误的是()

A . 50℃时A,B,C三种物质的溶解度由大到小的顺序是A>B>C
B . 50℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶液质量比为1:3
C . 将50℃时A,B,C三种物质的饱和溶液降温度20℃时,这三种溶液的溶质质量分数的大小关系是B>C=A
D . 将C的饱和溶液变为不饱和溶液,可采用降温的方法
学好化学能使我们更科学地认识、分析生活中的各种现象和事物。
-
(1) 氮肥能促进植物的枝叶繁茂,叶色浓绿。下列属于氮肥的是_____。A . KH2PO4 B . K2SO4 C . NH4NO3 D . Ca3(PO4)2
-
(2) 古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是_____(填字母)。A . 提供可燃物 B . 与氧气接触 C . 达到燃烧所需的最低温度
-
(3) “铁强化酱油”可补充人体所需的铁元素,铁元素摄入不足可能会引起的疾病是。
-
(4) 冶金工业常用CO还原氧化铁来冶炼金属铁,请写出该反应的化学方程式。
-
(5) 喝了汽水后常常会打嗝的原因是。
将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如下表
|
物质质量/组别 |
A |
B |
C |
D |
E |
|
NaCl质量/g |
5 |
15 |
20 |
30 |
40 |
|
所得溶液质量/g |
105 |
115 |
x |
130 |
136 |
-
(1) A组的溶液为(填“饱和”或“不饱和”)溶液。
-
(2) C组x的值为。
-
(3) 根据表中数据分析,20℃时NaCl的溶解度为。
-
(4) 若向饱和的石灰水中加入少量生石灰(CaO),充分搅拌,溶液的温度(填“升高”或“降低”);恢复至原来的温度后,所得溶液的质量(填“>”、“<”或“=”)原石灰水的质量。
如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )

A . t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B . t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C . t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D . 将t1℃时甲、乙的饱和溶液升温至t3℃,所得甲、乙的溶液仍都是饱和溶液
下列图像能正确反映对应变化关系的是( )
A .  加热一定量的高锰酸钾制氧气
B .
加热一定量的高锰酸钾制氧气
B .  表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C .
表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C .  常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D .
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D .  在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
 加热一定量的高锰酸钾制氧气
B .
加热一定量的高锰酸钾制氧气
B .  表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C .
表示将稀盐酸滴入氢氧化钠溶液中,在M点时,溶液中的溶质只有氯化钠
C .  常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D .
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D .  在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
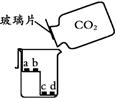
利用下图完成各题。
|
序号 |
甲 |
乙 |
丙 |
|
实验 |
| | a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
-
(1) 甲实验的目的是。
-
(2) 乙实验,若电解18g水,则试管2内得到的气体质量为g。
-
(3) 丙实验,说明二氧化碳密度大于空气且能与水反应的现象是。
如图表是硝酸钾固体在不同温度时的溶解度,回答以下问题。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
-
(1) 硝酸钾溶液中的溶剂是。
-
(2) 20℃时,向100g水中加入31.6g硝酸钾,充分溶解后得到(填“饱和”或“不饱和”)溶液。
-
(3) 20℃时,向100g水中加入40g硝酸钾,若使硝酸钾完全溶解,可以采用的方法是。
-
(4) 如图所示,小烧杯中盛放的是(2)中所得的硝酸钾溶液。若将下列物质分别缓慢地加入到大烧杯的水中,不断搅拌,能够使小烧杯中有固体析出的是。(填字母序号)

A冰 B硝酸铵 C干冰 D氢氧化钠
一定温度下,在饱和的硫酸铜溶液中继续投入少量硫酸铜固体,会发生改变的是( )
A . 溶解度
B . 溶液质量
C . 溶液密度
D . 溶液质量分数
煮沸的水不宜养鱼,是因为煮沸的水中几乎不含有( )
A . 氧元素
B . 氧原子
C . 氧分子
D . 氢元素
甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法正确的是( )

A . 甲、乙物质都适用降温结晶法使溶质从溶液中析出
B . 60℃时将40g甲物质加入50g水中能得到90g饱和溶液
C . 通过降温能使A点甲的不饱和溶液变为饱和溶液
D . 分别将甲、乙物质饱和溶液从60℃降至20℃,甲析出晶体较多
下列图像不能正确反应其对应的实验操作的是( )
A .  一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B .
一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B .  向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C .
向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C .  将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D .
将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D .  向盛有一定量稀硫酸的烧杯中不断加水稀释
向盛有一定量稀硫酸的烧杯中不断加水稀释
 一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B .
一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B .  向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C .
向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液
C .  将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D .
将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
D .  向盛有一定量稀硫酸的烧杯中不断加水稀释
向盛有一定量稀硫酸的烧杯中不断加水稀释
溶液与人们的生活密切相关。
-
(1) 用井水洗衣服时,肥皂不易起泡沫且产生大量浮渣,该井水是(填“硬水”或“软水”)。
-
(2) 洗洁精清洗碗壁上的油污,是利用了洗洁精的作用。
-
(3) 雨水会溶解空气里的部分CO2 , 故正常雨水的pH7(填“>”、“<”或“=”)
-
(4) 10%的葡萄糖口服液可用于低血糖症的治疗。配制50g溶质质量分数为10%的葡萄糖溶液,实验步骤为:
①计算:葡萄糖g;②称量;③量取;④;⑤装瓶贴签。
-
(5) 硝酸钾的溶解度曲线如图1所示。向100g水中加入硝酸钾固体或改变温度,得到相应如图2所示的混合物体系①~⑤。

Ⅰ、①中溶液(选填“是”或“不是”)饱和溶液。
Ⅱ、②中溶液的质量为g。
Ⅲ、②~③变化过程中,溶剂的质量,溶质的质量。(填序号)
A.不变 B.变大 C.变小
Ⅳ、⑤中析出晶体的质量为g。
高锰酸钾在生产、生活中有广泛的应用。工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如图所示。

[资料]相关物质的溶解度(20℃) 如表:
物质 | K2CO3 | KMnO4 |
溶解度/g | 111 | 6.34 |
-
(1) 过滤操作要使用玻璃棒,其作用是。
-
(2) 操作1的具体实验步骤为:加热浓缩、、过滤、洗涤、干燥,得到高锰酸钾晶体。滤液B是高锰酸钾的 (填“饱和”或“不饱和”)溶液。干燥时温度不宜过高的原因是(用化学方程式表示)。
-
(3) 从经济角度考虑,操作流程中可循环利用的物质是。
-
(4) “通 CO2酸化”反应的化学方程式为: 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 , 则锰元素化合价在反应前后的变化为。
-
(5) 若用稀硫酸酸化,反应的化学方程式为3K2MnO4+2H2SO4=2KMnO4+MnO2 ↓+2K2SO4+2X,则X的化学式为。但是工业上不采用稀硫酸酸化,请你推测K2SO4的溶解度与相同温度下的K2CO3和KMnO4中的更接近。
最近更新