第3节 化学方程式的书写与运用 知识点题库
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
反应后烧杯及所盛物质的总质量/g | 191.2 | 214.4 | 238.6 | 263.6 |
请你分析并计算(保留一位小数):
-
(1) 第一次加入稀盐酸充分反应后,生成二氧化碳的质量是g;
-
(2) 实验过程中,所加盐酸在第次时碳酸钙已经完全反应;
-
(3) 产品中碳酸钙的质量g;碳酸钙的质量分数 ;该产品 (填“合格”或“不合格”)。
①A+B→C+H2O ②C+KOH→D↓(蓝色)+E
③B+Ba(NO3)2→F↓+HNO3写出这三个反应的化学方程式
-
(1)
-
(2)
-
(3)
 SO2↑
B . 4Al +3O2
SO2↑
B . 4Al +3O2  2Al2O3
C . P+O2
2Al2O3
C . P+O2  PO2
D . Mg+O2
PO2
D . Mg+O2  MgO2
MgO2

[提出问题]析出的白色固体是什么?
[进行猜想]①NH4Cl;②(NH4)2CO3;③NH4HCO3;④Na2CO3;⑤NaHCO3
[收集证据]佐证一:设计实验,检验析出的白色固体是上述猜想中的哪一种物质?首先向白色固体中滴加氢氧化钠溶液,并微热,没有察觉到现象,说明不是铵盐。
当检验是哪种钠盐时,做对比实验。取过量的碳酸钠、碳酸氢钠和析出的白色粉末三种物质,分别装在相同的三个气球中,再将瘪气球系紧在装有等量的盐酸的试管口上,并做如下实验(如图)

B和C产生的气体体积相等,该气体是,则侯德榜实验中,析出的白色粉末的是。
佐证二:查找上述五种物质在常温下的溶解度资料是:
| ①NH4Cl | ②(NH4)2CO3 | ③NH4HCO3 | ④Na2CO3 | ⑤NaHCO3 |
| 37.2g | 100g | 21.7g | 21.5g | 9.6g |
通过溶解度分析判断,析出的白色固体与上述实验判断的物质相同。
[反思交流]①.通过溶解度判断析出的物质也是(3)的结论,理由是;
②在化肥中没有碳酸铵,原因之一是碳酸铵在空气中,吸收某些成分会变成碳酸氢铵。反应方程式为。
③侯德榜实验析出一种白色固体,过滤出固体,得到滤液。要检验滤液中含有Cl-和CO32- , 你检验的方法是。
 D . 此反应中,X、Y、Z三种物质的质量比为2:2:3
D . 此反应中,X、Y、Z三种物质的质量比为2:2:3
 电解水
B .
电解水
B .  将等质量的镁和铁分别投入到盛有足量同种稀硫酸的两个容器中
C .
将等质量的镁和铁分别投入到盛有足量同种稀硫酸的两个容器中
C .  等体积、等溶质质量分数的过氧化氢溶液制取氧气
D .
等体积、等溶质质量分数的过氧化氢溶液制取氧气
D .  服用胃舒平
服用胃舒平 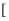 主要成分是Al(OH)3]治疗胃酸过多,胃液pH的变化
主要成分是Al(OH)3]治疗胃酸过多,胃液pH的变化

-
(1) 在上图D中的圆圈内填入正确的化学式:D中。
-
(2) 用化学方程式表示图中所体现的化学反应
-
(1) Cu2O中铜元素的化合价为价。
-
(2) 所得滤液中溶质的质量分数。
-
(3) 若将上述23.0g稀硫酸,稀释为溶质的质量分数为4.9%的溶液,需要加入水的质量。
-
(1) 该黄铜样品中锌的质量.
-
(2) 反应后所得溶液的溶质质量分数(计算结果保留0.1%).
-
(3) 若要用98%的浓硫酸来配制100g溶质质量分数为9.8%的稀硫酸需加水的质量.

-
(1) 配平化学方程式:
 1
1  2
2 
 。
。
-
(2) 71gCl2完全反应,理论上最多生成ClO2的质量为g。



-
(1) 图1中的反应现象为。该化学反应方程式为。
-
(2) 图2中的集气瓶中加入的液体可能是。写出该液体与硫燃烧产物反应的化学方程式。
 B . 氢氧化钠溶液中加入硫酸铜溶液:
B . 氢氧化钠溶液中加入硫酸铜溶液:  C . 硫在空气中燃烧
C . 硫在空气中燃烧  D . 焦炭还原铁矿石:
D . 焦炭还原铁矿石: 
 H2↑+ O2↑
C . 3CO +Fe2O3
H2↑+ O2↑
C . 3CO +Fe2O3 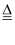 2Fe+3CO2
D . 3Fe + 4O2
2Fe+3CO2
D . 3Fe + 4O2  Fe3O4
Fe3O4
 。现取一定量的碱式碳酸铜固体进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
。现取一定量的碱式碳酸铜固体进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( ) 

已知:相同温度下,装置内压强与产生气体的体积成正比。
-
(1) 根据图乙可知,充分反应后产生氢气的质量:MgAl(填“>”、“<”或“=”)。
-
(2) 计算镁片与稀盐酸反应产生氢气的质量(写出计算过程)。
-
(3) 曲线BC段下降的原因是。
-
(4) t4时消耗镁片与铝片的质量比为。
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入碳酸钠溶液的质量/g |
40.0 |
40.0 |
40.0 |
40.0 |
40.0 |
|
反应后溶液的总质量/g |
88.9 |
127.8 |
M |
205.6 |
245.6 |
请根据实验数据分析解答下列问题。
-
(1) 表格中M的数值为。
-
(2) 该碳酸钠溶液的溶质质量分数是多少?(精确到0.1%)
 在密闭容器中点燃CO和O2的混合气体
B .
在密闭容器中点燃CO和O2的混合气体
B .  电解水实验中,产生氢气和氧气的质量关系
C .
电解水实验中,产生氢气和氧气的质量关系
C .  在密闭容器中引燃红磷
D .
在密闭容器中引燃红磷
D .  表面镀锌的铁板与足量的稀硫酸反应
表面镀锌的铁板与足量的稀硫酸反应
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量合计/g | 50 | 65 | 80 | 100 |
生成的沉淀质量/g | 0.98 | 1.96 | 2.94 | 2.94 |
请回答:
-
(1) 加入50g氢氧化钠溶液后,混合溶液中所含的阳离子为 (填离子符号)。
-
(2) 混合溶液中硫酸铜的质量分数是多少?
-
(3) 画出在该混合溶液中加入氢氧化钠溶液质量与生成沉淀质量变化关系的曲线(标出折点坐标)。




