第2节 金属矿物 铁的冶炼 知识点题库
根据下图回答问题。
(1)仪器a的名称是 ,装置A中是用 法收集气体。
(2)实验室用装置B完成的实验是 (填字母序号)。
a.加热高锰酸钾制取氧气
b.过氧化氢溶液与二氧化锰混合制取氧气
c.大理石与稀盐酸反应制取二氧化碳
(3)装置C中玻璃管内可以观察到的现象为 ,发生反应的化学方程式为 ,澄清石灰水中发生反应的化学方程式为 。

-
(1) 生铁和钢的主要成分是 ,炼铁的主要设备是 .
-
(2) 已知试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等.两支长颈漏斗中产生的现象的不同之处是 .若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量 (填“多”、“少”或“相等”).
-
(3) 衣服上的油污用汽油洗比用水洗效果更好,原因是 ,但若在水中加入洗涤剂,也会有很好的洗涤效果,原因是洗涤剂可以起到作用.
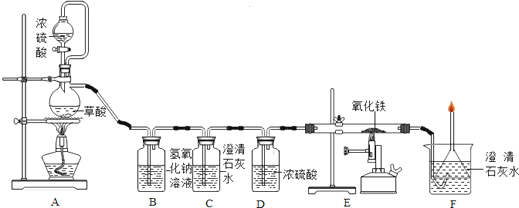
请回答下列问题:
-
(1) C装置无明显现象,C装置的作用是.
-
(2) E装置中的实验现象是.
-
(3) F装置的作用是.
-
(1) 铁的广泛应用
某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为 .
-
(2) 铁锈成分的探究
(1)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是 (选填序号).

(2)铁生锈的主要过程为:Fe
 Fe(OH)2
Fe(OH)2 Fe(OH)3
Fe(OH)3 Fe2O3•xH2O
Fe2O3•xH2O次要过程为:Fe
 FeCO3
FeCO3写出Fe→Fe(OH)2反应的化学方程式 .
(3)铁锈组成成分的确定
某铁锈成分为Fe2O3•xH2O和FeCO3 . 为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用如图装置进行实验.

【查阅资料】①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2 . ②温度高于500℃时铁的氧化物才能被CO还原.③碱石灰的主要成分是氢氧化钠和氧化钙.
①装配好实验装置后,首先要 .
②装置A中的反应为:H2C2O4(草酸)CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.
则样品中FeCO3的质量m(FeCO3)= g,x= .
④若缺少G装置,测得的m(FeCO3)(选填“偏大”、“偏小”、“不变”,下同),
x的值会 .
-
(3) 炼铁过程的探究
(1)写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式 .
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO
 2Fe3O4+CO2
2Fe3O4+CO2阶段2:Fe3O4+CO
 3FeO+CO2
3FeO+CO2阶段3:FeO+CO
 Fe+CO2
Fe+CO2(2).将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼铁过程的探究.加热时测定D中剩余固体质量随温度变化的曲线如图所示.图中M点对应的a= .

-
(1) 人类向自然界提取量最大的金属是(写化学式),高炉炼铁的原料是铁矿石、空气、石灰石和(写名称);写出高温下一氧化碳把铁从赤铁矿石中还原出来的化学方程式.
-
(2) 铝的活动性比铁强,但在生活中常在铁的表面涂上铝粉.其原因是.
-
(3) 金属钴(Co)与铁具有相似的化学性质.CoCl2固体是蓝色的,CoCl2溶液是粉红色的.现将金属钴投入稀盐酸中,发生化学反应Co+2HCl═CoCl2+H2↑.该反应的实验现象为.
-
(4) 用Fe、Ag和溶液可以一次性验证Fe、Cu、Ag三种金属的活动性顺序(写化学式),写出能发生反应的化学方程式.
-
(1) 【教师提醒】它由Cu、Fe2O3二种固体中的一种或两种组成.
【提出猜想】红色粉末可能的组成有:①只有Cu;②只有;③是Cu、Fe2O3的混合物
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【实验探究】
甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为的观点正确(填“甲”或“乙”).
-
(2) 应该选择组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第组(填序号).
-
(3) 丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
反应前
反应后
Ⅰ组
玻璃管和红色粉末的总质量为37.3g
玻璃管和固体物质的总质量为36.1g
Ⅱ组
洗气瓶和所盛溶液的总质量为180.0g
洗气瓶和瓶中物质的总质量为183.1g
【交流讨论】
在装置A中先通CO气体的作用是.
-
(4) 写出A装置中发生反应的化学方程式;实验中观察到A装置中的现象为.

-
(5) 为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?(填“需要”或“不需要”),理由是.
-
(6) 【反思评价】丁同学指出:从环保角度,如图装置有严重不足之处.你认为应该如何改进?.
① |
| 地壳中含量最多的金属元素是; | ② |
| 松花江跨江桥的建设中用到了钢,钢的含碳量范围是; |
③ |
| 很多宝石中含有才使它们变得绚丽多彩; | ④ |
| 钛合金与人体有很好的,因此可以用来制造人造骨; |
⑤ |
| 菱铁矿主要成分的化学式为; | |||

-
(1) 如图是一氧化碳还原氧化铁实验装置图,回答下列问题:
①写出甲处玻璃管中的化学反应方程式;丙处酒精灯的作用是.
②下列关于该实验的说法正确的是(填字母)
A.装置甲处玻璃管内黑色粉末变红
B.实验结束后,应先熄灭甲处的酒精喷灯
C.一氧化碳发生了还原反应.
-
(2) 每年因腐蚀而浪费掉的金属材料数量惊人,铁栅栏常采取的防腐措施是.除防止金属腐蚀外,保护金属资源的有效途径还有.(答一点即可)

-
(1) A实验中,碳酸钙和稀盐酸反应的基本类型为,当反应结束时,气球已经完全鼓起,天平指针向右偏,出现该现象的原因可能是.(填字母序号)
a.该反应前后原子数目减少 b.生成气体的反应不遵循质量守恒定律
c.空气的浮力干扰了实验结果 d.该反应生成物的总质量小于反应物的总质量
-
(2) B实验中,试管中装有足量同样的稀盐酸,两个气球中分别装有质量相同的金属A和B(都为+2价),提起气球,加入金属,反应开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束恢复到室温时,甲气球鼓起的比乙气球大,该实验说明:
①金属活动性AB(填“>”或“<”,下同);②相对原子质量AB.
-
(3) C实验,用来验证二氧化碳与氢氧化钠能够发生反应,加入试剂的顺序是
(填字母序号“a.先加入盐酸后加入氢氧化钠溶液”或“b.先加入氢氧化钠溶液后加入盐酸”),整个实验过程中,气球的变化是,请写出二氧化碳与氢氧化钠反应的方程式.
-
(4) D实验中,小气球的作用是,玻璃管中的反应方程式为,
(填“能”或“不能”)根据通入的CO的质量计算生成的铁的质量.
①C+O2  CO2②Fe2O3+3H2
CO2②Fe2O3+3H2  2Fe+3H2O
2Fe+3H2O
③Fe2O3+3CO  2Fe+3CO2
2Fe+3CO2
④2Fe2O3+3C  4Fe+3CO2↑
4Fe+3CO2↑
⑤CO2+C  2CO
2CO
| 选项 | 反应物及反应条件 | 化学反应方程式 | 实验现象 |
| A | 铁丝在氧气中点燃 | 4Fe+3O2 | 剧烈燃烧,火星四射,生成黑色固体 |
| B | 磷在空气中点燃 | 4P+5O2 | 产生大量白雾,放出大量的热量 |
| C | 将CO2通入到滴有紫色石蕊试液的水中 | CO2+H2O=H2CO3 | 滴有紫色石蕊试液的水由紫色变为蓝色 |
| D | 将H2通入CuO片刻并加热 | CuO+H2 | 黑色的粉末逐渐变为亮红色,试管口有冷凝的液体滴下 |
查阅资料:CO2+Zn  CO+ZnO;FeCl3溶液遇KSCN溶液变红。
CO+ZnO;FeCl3溶液遇KSCN溶液变红。

请回答下列问题:
| 将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D进行加热,其产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验: 步骤 | 操作 | 甲组现象 | 乙组现象 |
| ① | 取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) | 溶解,有气泡,溶液呈浅绿色 |
| ② | 取步骤1所得溶液,滴加KSCN溶液 | 变红 | 无现象 |
-
(1) 则乙组装置D玻璃管中反应的化学方程式是,甲组得到的黑色粉末是。
-
(2) 从安全考虑,本实验应在装置和之间再添加装置E防止倒吸(填字母编号)。
-
(3) 该对比实验结果表明CO的还原能力随温度的升高而(填“增强”或“减弱”)。
①装置甲、乙、丁中的试剂分别是浓硫酸、氢氧化钠溶液、澄清石灰水; ②实验时先点燃丙、戊处的酒精灯,过一会再通入混合气体; ③该实验既可验证一氧化碳的还原性,又可验证一氧化碳的可燃性; ④实验中会观察到甲、丁中液体均变浑浊; ⑤实验结束后称量丙中固体质量为ng,则样品中氧化铁的质量分数为10(m-n)/3m×100% ⑥利用丁装置在反应前后改变的质量也能计算出氧化铁的质量分数



-
(1) A处加热一段时间后,试管中的现象是。
-
(2) B处石灰水变浑浊,其反应的化学方程式是,
-
(3) 若能说明A处反应的气体产物中有一氧化碳,依据的一个现象是。
为进一步确定碳与氧化铜反应产生一氧化碳的质量,该同学测量了如下数据:
A处
试管内物质
B处
瓶内物质
C处
玻璃管内物质
D处
瓶内物质
反应前后质量变化量
(g)
a
b
c
d
则一氧化碳的质量m(CO)=。(用上述字母表达)
-
(4) 停止实验,待C处玻璃管冷却,倒出固体于试管中,加入足量稀硫酸,看到现象,则推出固体的成分是氧化铜和铜。
-
(1) 工业上用一氧化碳和褐铁矿炼铁的原理是(用化学方程式表示)。
-
(2) 依据化学式计算MnO(OH)的相对分子质量是88,计算式为。
-
(1) 自然界存在的赤铁矿属于是(填“纯净物”或“混合物”)。
-
(2) 工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为。
-
(3) 废旧钢铁表面的铁锈(主要是氧化铁)可用盐酸除去,其原理是(用化学方程式表示)。

-
(1) 地球上的铁元素以(“单质”或“化合物”)的形式存在。可用于炼铁的一种矿石是。
-
(2) 用生铁制防盗门而不用纯铁的主要原因是。在防盗门表面喷漆,其防锈原理是,喷漆前用稀盐酸除铁锈的化学方程式为。

-
(1) 写出装置A中硬质玻璃管中反应的化学方程式。
-
(2) 某同学认为该装置不需要再补充尾气处理装置,其理由什么?。





 2Fe2O3
2Fe2O3 Cu+H2O
Cu+H2O


