课题1 质量守恒定律 知识点题库
-
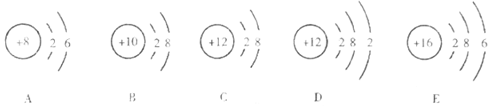
(1) 从宏观知微观气体X在氧气中燃烧生成氮气和水,X分子中一定含有原子。
-
(2) 从微观知宏观:微粒A、B、C、D、E中,共有种元素,元素的化学性质相似的是,A和D组成化合物的化学式是。

 N2+H2O
C . 甲物质由一个氧原子和一个氮原子构成
D . 反应前后,原子种类、原子数目不变
N2+H2O
C . 甲物质由一个氧原子和一个氮原子构成
D . 反应前后,原子种类、原子数目不变
 4CO2+2X+6H2O,则X的化学式为()
4CO2+2X+6H2O,则X的化学式为()

步骤一:检查发生装置的气密性。
步骤二:往烧瓶中装入适量的二氧化锰粉未。关闭分液漏斗的活塞,并将适量的过氧化氢溶液倒入分液漏斗中,测出发生装置的总质量为m1g。
步骤三:取一个集气瓶,用记号笔在适当位置做标记,将水注入集气瓶到标记处,用量筒测出这些水的体积为V0 mL。再将集气瓶灌满水倒扣在水槽中等待收集。
步骤四:打开活塞,滴入过氧化氢溶液,同时开始收集气体。调节集气瓶在水中的上下位置,当集气瓶内、外的液面相平且刚好达到标记处时(如图)暂停反应。
步骤五:重复步骤四,再收集9瓶气体。
步骤六:称出反应后发生装置的总质量为m2g。
-
(1) 小明通过该实验,测得氧气的密度是g/mL。
-
(2) 步骤四中,控制集气瓶内、外液面保持相平的目的是。
-
(3) 如果实验中装置气密性不良,将对测得的密度值有何影响?,请说明理由:。
-
(1) 口罩成为每个人的生活必需品,医用口罩生产中采用环氧乙烷灭菌消毒。环氧乙烷 的化学式为 C2H4O,环氧乙烷由 种元素组成,一个环氧乙烷分子中的电子总数为个,氧原子在化学反应中易 (填“得到”或“失去”)电子,形成相对稳定 结构。
-
(2) 环氧乙烷的相对分子质量为 ,碳、氢、氧元素的质量比为 。
-
(3) 如图是酒精完全燃烧的微观示意图。

①已知:“
 ”的相对原子质量是“
”的相对原子质量是“  ”的 a 倍,该反应中“
”的 a 倍,该反应中“  ”和“
”和“  ”的质量比是(用含 a 的式子表示;方程式中物质质量比=系数*相对分子质量之比)。
”的质量比是(用含 a 的式子表示;方程式中物质质量比=系数*相对分子质量之比)。②酒精易挥发且易燃,挥发是因为(从微观上解释)。 写出上述微观示意图所表示的化学方程式 。


下列说法错误的是( )
-
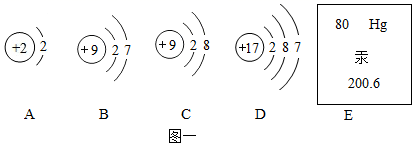
(1) 图一中A~D是四种粒子的结构示意图,E是汞元素在元素周期表中的信息。
①汞元素的原子序数是。
②A~D四种粒子中,具有相对稳定结构的是(填字母)。
③B、D化学性质相似的原因是。
-
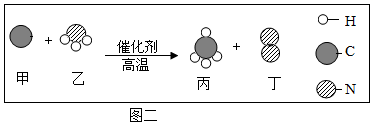
(2) 图二是某反应的微观示意图。
①反应物和生成物中属于单质有种。
②该反应消耗物质乙和生成物质丙的质量比为(填最简整数比)。
-
(1) 反应后生成的沉淀质量为克.
-
(2) 所得滤液中溶质的质量分数为多少?(用百分数表示,写出计算过程.)

-
(1) 图1中仪器a的名称为。实验中发现进入集气瓶的水不足五分之一,其可能的原因是(写出一种即可)。
-
(2) 图2中铜片上的红磷没有燃烧的原因是。
-
(3) 图3是质量守恒定律的验证实验。红磷燃烧时发生反应的化学方程式是。实验时若取用红磷的量不足,对实验的结果(填“有”或“没有”)影响。
| 物质 | X | Y | M | N |
| 反应前各物质的质量/g | 5 | 2 | 14 | 18 |
| 反应后各物质的质量/g | 20 | x | 4 | 13 |

 和
和  分子保持不变
B . 该反应为分解反应
C . 参加反应的
分子保持不变
B . 该反应为分解反应
C . 参加反应的  与
与  分子数之比为3:1
D . 物质X含4种元素
分子数之比为3:1
D . 物质X含4种元素
-
(1) 通过电解水实验,得出了水的组成,电解水的化学反应方程式为。
-
(2) 饮用硬度过高的水不利于人体健康,生活中常用的方法来降低水的硬度, 常用来区分硬水与软水。
-
(3) 爱护水资源人人有责。下列做法有利于保护水资源的是。
A 用洗菜水浇花
B 大量使用农药和化肥
C 工业废水不经处理就直接排放
D 农业和园林浇灌改大水漫灌为喷灌、滴灌
-
(4) 水中的病菌过多时,要使用消毒剂进行消毒杀菌。ClO2是一种饮用水消毒剂,其生产的化学反应方程式为2NaClO2+X=2ClO2+2NaCl,据此可推断出X的化学式为。
-
(5) 自然界中的水一般要经过净化后才能使用。吸附、过滤、蒸馏三种净水操作中,单一 操作相对净化程度最高的是。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:相等; 猜想2:不相等。
-
(1) (实验探究)甲、乙两组同学用托盘天平分别称量反应前、后物质的质量。
甲组
乙组
实验方案
(反应后略)


实验现象
红磷燃烧,放出热量,产生大量,冷却后称量,天平指针没有偏转。
有气泡产生,天平指针向偏转(填“左”或“右”)。
结论
猜想1正确
猜想2正确
-
(2) (反思评价)究竟哪种猜想正确?同学们研究两个反应的反应物与生成物特点:甲组反应的化学方程式为:,乙组反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;两个反应装置的特点:甲组反应在中进行,乙组反应没有密封。

-
(3) (改进装置)如果乙组反应也密封起来会怎么样呢?同学们对乙组装置进行了如图两种改进,你认为最佳装置是(填字母)。
-
(4) (得出结论)同学们用改进后的最佳装置再次进行探究,均得出猜想1正确。最终得出的结论是。
-
(5) (解释)在化学反应中反应前后原子的种类、、质量均不变,所以质量守恒。


反应前 | 反应后 | |
烧杯和稀盐酸总质量 | 鸡蛋壳的质量 | 烧杯和剩余物总质量 |
130g | 6.25g | 134.05g |
-
(1) 反应生成CO2的质量为g。
-
(2) 请你帮助小明同学计算收集的鸡蛋壳中碳酸钙的质量分数。(写出计算过程)
 )
)
-
(1) 稀硫酸溶液中溶质的质量为 g。
-
(2) 氢氧化钠溶液的溶质质量分数。
 , X的化学式为( )
, X的化学式为( )



