专题五 化学变化及其表示 知识点题库

| 物质 | X | Y | Z | W |
| 反应前质量/g | 10 | 3 | 90 | 0 |
| 反应后质量/g | 4 | 3 | 待测 | 5 |
 ×100%
D . NH4NO3受热发生分解反应,可能产生SO2气体
×100%
D . NH4NO3受热发生分解反应,可能产生SO2气体
| 选项 | 事实 | 解释 |
| A | 加热氯酸钾时误将高锰酸钾加入后,反应速率加快了 | 高锰酸钾是该反应的催化剂 |
| B | 600升氧气被压缩在40升的钢瓶中 | 分子之间有一定间隔 |
| C | 变瘪的乒乓球放入热水中能鼓起来 | 分子大小随温度改变而改变 |
| D | 二氧化碳不支持燃烧 | 二氧化碳的密度比空气大 |
 2Fe2O3
D . 3CO + Fe2O3
2Fe2O3
D . 3CO + Fe2O3  2 Fe + 3 C O 2
2 Fe + 3 C O 2
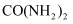 )的流程图。请按要求回答相关问题:
)的流程图。请按要求回答相关问题: 
-
(1) X是空气中含量最多的气体,其化学式为。
-
(2) CH4燃烧生成二氧化碳,并放出大量的热,其完全燃烧的化学方程式为。
-
(3) 上述流程中用氨气和二氧化碳合成尿素的化学方程式为,尿素属于(填“氮肥”“磷肥”或“钾肥”)。

-
(1) 写出标号仪器的名称:①。
-
(2) 实验室用A装置制取O2的化学方程式为。
-
(3) 实验室用B装置制取CO2的化学方程式为,属于反应(填基本反应类型)。长颈漏斗的下端管口要伸入液面以下,目的是。
-
(4) 实验室常用锌粒和稀硫酸制备氢气。反应的化学方程式为。发生和收集氢气的装置为(写一组)。氢气是种高能燃料,点燃氢气前需要。
月壤与地球土壤富含微生物和有机养分不同,月壤不含任何有机养分,而且非常干燥,无论种菜还是种土豆都不行。但是科学家们发现,长期的太阳风给月壤注入了大量的氦﹣3,这是一种未来有可能进行热核聚变发电的清洁能源。有研究显示,100吨氦﹣3所能创造的能源相当于全世界一年消耗的能源总量。
月壤的形成主要是由于陨石撞击的作用,在高温下使得基岩熔融、粉碎和岩化所形成。除了氦﹣3之外,月壤中还含有铁、钙、镁等以及天然的铅、铜、铁、锑、铼等矿物质颗粒,是一种富含金属元素的稀有土壤。这些新型天然矿物质颗粒很有可能会成为地球最新的“依赖”资源,同时还有可能揭秘太阳初期演化的历史进程、太阳表层的组织成分和成分特征等。阅读上述材料,回答下列问题:
-
(1) 文中提到的月壤含有“铁、钙、镁等”指的是。
-
(2) 材料说明,月壤(填“能”或“不能”)用来种菜。
-
(3) 氦﹣3未来有可能是一种清洁能源,你知道的清洁能源有(任写一种)。
-
(4) 结合材料,从生锈的条件进行分析,铁制品在月球表面不易生锈的原因是,月壤中含铁矿物质颗粒的主要成分是氧化铁,可用于工业炼铁,其炼铁原理是。(用化学方程式表示)
-
(5) 研究月壤成分的前景有(任写一种)。
 2Fe2O3
C . CaCO3=CaO+CO2↑
D . 2Mg+CO2
2Fe2O3
C . CaCO3=CaO+CO2↑
D . 2Mg+CO2  2MgO+C
2MgO+C

-
(1) 图1为硫在氧气中燃烧,用NaOH溶液替代水是因为NaOH溶液对硫燃烧的产物SO2吸收效果更好,硫在氧气中燃烧的现象是,写出用NaOH溶液吸收SO2(与CO2性质相似)的化学方程式。
-
(2) 用图2的装置进行实验(夹持仪器略去)。将稀盐酸全部注入A中,反应的化学方程式为。B中观察到的现象是。
-
(3) 图3中锥形瓶敞开放置。一段时间后,电子秤示数变大,瓶中的固体可能是(填写一种即可)。
-
(4) 如图4实验操作可完成去除粗盐中的难溶性杂质和配制一定溶质质量分数溶液的实验。

①去除粗盐中难溶性杂质,实验的操作步骤是(填字母序号)。
②实验操作E中玻璃棒的作用是。
 B . 电解水
B . 电解水  C . 镁在氧气中燃烧
C . 镁在氧气中燃烧  D . 等质量、等浓度的过氧化氢完全分解
D . 等质量、等浓度的过氧化氢完全分解 
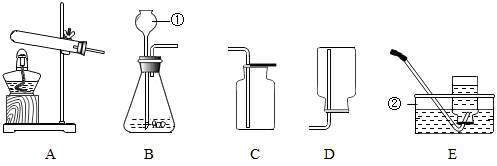
-
(1) 写出装置中标号仪器的名称:①②。
-
(2) 实验室用A装置加热高锰酸钾的方法制取氧气,需在试管口塞一团棉花,其作用是,高锰酸钾的颜色是,该反应的符号表达式为。
-
(3) 实验室用A、E装置加热高锰酸钾制取氧气,收集氧气完成后,测得氧气的纯度明显偏低,原因可能是。(填字母、可多选)
A 高锰酸钾中混入了二氧化锰 B 收集前集气瓶中未注满水
C 收集后,集气瓶中仍有少量水 D 未见气泡连续均匀冒出时就开始收集
-
(4) 收集氧气以探究石蜡燃烧的产物,应选择装置A与(填收集装置字母编号)组合。收集过程中检验氧气集满的方法是。
-
(5) 用大理石与稀盐酸反应制取二氧化碳的符号表达式为,选择的发生装置是(填字母编号)。
-
(6) 用A、E 装置加热氯酸钾和二氧化锰的混合物制取氧气,主要步骤有:①固定装置;②装入药品;③加热;④检查装置的气密性;⑤用排水法收集;⑥熄灭酒精灯;
⑦移出导气管。正确的操作顺序应是,该实验中固定试管时应使管口略向下倾斜,原因是。
-
(7) 同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验
30%双氧水的质量
加入水的体积
二氧化锰质量
收集时间
1
10g
40 mL
5g
200秒
2
20g
30 mL
5g
100秒
3
30g
20 mL
?
67秒
①取用二氧化锰的仪器是(填写名称)。

②上述反应的符号表达式为。
③实验3中加入二氧化锰的质量为g。
④相同条件下,实验3产生氧气的速率最大,说明。
| 序号 | 化学反应事实 | 影响化学反应的因素 |
| A | 木炭在氧气中燃烧比在空气中燃烧更旺 | 反应物浓度 |
| B | 铜片在空气中难燃烧,纳米级铜粉在空气中易燃烧 | 反应物的种类 |
| C | H2O2在常温下分解缓慢,但在加入MnO2后迅速分解 | 催化剂 |
| D | 同种食品在夏天比冬天更容易变质 | 反应温度 |



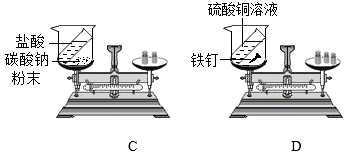
-
(1) 上述实验中能验证质量守恒定律的是(填字母标号)。
-
(2) 实验D中反应的化学方程式为。
-
(3) AgNO3固体见光分解会产生一种有刺激性气味的气体,该气体可能是 (填字母)。A . SO 2 B . NH3 C . NO2 D . N2
反应前 | 反应后 | |
烧杯和稀盐酸的质量 | 大理石样品的质量 | 烧杯和其中混合物的质量 |
150g | 12g | 157.6g |
-
(1) 反应中生成二氧化碳的质量。
-
(2) 该大理石样品中碳酸钙的质量。
第一步 | 第二步 | 第三步 | |
实验过程 | 取50克样品加足量蒸馏水,搅拌静置后,过滤,再将滤液转移到烧杯中 | 在烧杯中加足量CaCl2溶液充分反应(杂质不参与反应),得到沉淀 | 将沉淀过滤、洗涤、烘干后得到5g固体 |
请计算样品中碳酸钾的质量分数(结果精确到0.1%)。

-
(1) Ⅱ中发生化合反应的化学方程式为。
-
(2) 98% 的硫酸中溶质与溶剂的质量比为。
-
(3) 上述流程中的含硫物质有 S、和 H2SO4。



