单元2 质量守恒定律 知识点题库
一种焰火火药中所含的Cu(NO3)2在燃放时产生绿色火焰,发生如下反应:2Cu(NO3)2 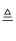 2CuO+O2↑+4X↑,其中X是一种污染空气的有毒气体,依据质量守恒定律,推测X 应是( )
2CuO+O2↑+4X↑,其中X是一种污染空气的有毒气体,依据质量守恒定律,推测X 应是( )
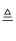 2CuO+O2↑+4X↑,其中X是一种污染空气的有毒气体,依据质量守恒定律,推测X 应是( )
2CuO+O2↑+4X↑,其中X是一种污染空气的有毒气体,依据质量守恒定律,推测X 应是( )
A . NO2
B . NO
C . N2O5
D . N2O
下列图象分别与选项中的操作相对应,其中合理的是( )
A .  加热氯酸钾和二氧化锰的混合物
B .
加热氯酸钾和二氧化锰的混合物
B .  往一定量的NaOH和Ba(OH)2的混合溶液中加入稀硫酸至过量
C .
往一定量的NaOH和Ba(OH)2的混合溶液中加入稀硫酸至过量
C .  向等质量的镁、铁中分别加入稀盐酸
D .
向等质量的镁、铁中分别加入稀盐酸
D .  室温下,向一定质量的饱和石灰水中加入氧化钙
室温下,向一定质量的饱和石灰水中加入氧化钙
 加热氯酸钾和二氧化锰的混合物
B .
加热氯酸钾和二氧化锰的混合物
B .  往一定量的NaOH和Ba(OH)2的混合溶液中加入稀硫酸至过量
C .
往一定量的NaOH和Ba(OH)2的混合溶液中加入稀硫酸至过量
C .  向等质量的镁、铁中分别加入稀盐酸
D .
向等质量的镁、铁中分别加入稀盐酸
D .  室温下,向一定质量的饱和石灰水中加入氧化钙
室温下,向一定质量的饱和石灰水中加入氧化钙
在某过氧化氢溶液中,氢元素和氧元素的质量比为2:17,现向38g该溶液中加入1g二氧化锰,充分反应生成氧气的质量为( )
A . 2g
B . 3.2g
C . 8.4g
D . 17g
某纯净物M燃烧的化学方程式为CH4+2O2  CO2+2M,则M的化学式是( )
CO2+2M,则M的化学式是( )
 CO2+2M,则M的化学式是( )
CO2+2M,则M的化学式是( )
A . H2O2
B . H2O
C . O2
D . O
含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了 SO2 , 同时还得到了某种化工产品。该工艺流程如图所示,下列叙述错误的是( )

A . 该流程中可得到化工产品 H2SO4
B . 图中 FeSO4 → Fe2(SO4)3 的反应类型是复分解反应
C . 该流程中化合价发生改变的元素为 Fe、S 和 O
D . 图中吸收 SO2 的化学反应方程式为:Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4
某物质在纯氧中燃烧生成了氮气和水蒸气,该物质一定含有( )
A . 氮元素和氢元素
B . 氮元素和氧元素
C . 氮元素、氢元素和氧元素
D . 氢元素和氧元素
在一个密闭容器中放人甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 18 | 1 | 2 | 32 |
| 反应后质量/g | X | 26 | 2 | 12 |
下列说法中,错误的是()
A . 反应后物质甲的质量为13g
B . 乙是反应物
C . 反应中乙、丁的质量比为5∶4
D . 物质丙可能是该反应的催化剂
能源、环境与人类的生活和社会发展密切相关。
-
(1) 目前,作为主要能源的化石燃料包括煤、石油和,其燃烧产生温室气体的原因是。
-
(2) 为减少温室气体排放,研究开发NH3进行燃烧,前景广阔。
①NH3中氮元素和氢元素的质量比为。
②NH3燃烧的化学方程式为4NH3+3O2
 6H2O+。
6H2O+。
高锰酸钾和浓盐酸发生如下应:2KMnO4+16HCl=2KCl=2MnCl2+5X↑+8H2O根据质量守恒定律,推测X应是()
A . HClO
B . ClO2
C . O2
D . Cl2
科学家用通电的方法使水分解(图1),从而证明了水的组成。

-
(1) 把水注入水电解装置中,接通直流电源一段时间后,可以观察到的现象是;反应的符号表达式为。
-
(2) 检验b管中产物的方法是____(填字母序号)。A . 用点燃的木条接近玻璃管尖嘴部分,慢慢打开活塞 B . 用带火星的木条接近玻璃管尖嘴部分,慢慢打开活塞 C . 用内壁沾有澄清石灰水的烧杯罩在尖嘴上方,慢慢打开活塞
-
(3) 科学家还用点燃氢气,证明燃烧产物的方法证实了水的组成。如果将电解水产生的氢气直接缓缓地通过装有足量无水硫酸铜(无水硫酸铜遇水显蓝色)的仪器c,在导管口d处点燃,然后把盛有冷水的烧杯罩于如上图所示的位置。实验过程中可以观察到烧杯底部的现象是。
-
(4) 研究物质的化学反应,可以揭示物质的组成和物质之间转化的规律:
①根据化学反应前后不变的原理,设计实验使物质参与一个化学反应,通过分析反应物或生成物的元素组成进一步确定该物质的组成元素。
②已知同温同压下,气体的体积比等于分子的个数比。根据反应生成氢气和氧气的体积比,可推求出:一个水分子由构成。
③如图是表示水分解时变化过程的微粒示意图,其出现的正确顺序是(写字母表示)。

根据化学方程式X+3O2=2CO2+3H2O,可推断X的化学式是()
A . CH4
B . CH4O
C . C2H6O
D . NH3
氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是( )
A . H2
B . Cl2
C . NaOH
D . NaNO3
某实长小组同学用氯酸钾和二氧化锰的混合物制取氧气。取一定质量的氯酸钾与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表
|
加热时间 |
t1 |
t2 |
t3 |
t4 |
|
剩余固体质量(g) |
3.20 |
2.88 |
2.49 |
2.49 |
试计算:
-
(1) 完全反应后产生的氧气的总质量为g。
-
(2) 原氯酸钾和二氧化锰的总质量是多少?
请你结合所学的化学知识回答下列问题:
-
(1) 请选择下列物质填空:A 一氧化碳;B 活性炭;C 氢气;D 氦气;E 干冰。
①可用于人工降雨的是(填字母,下同)。
②人类理想的清洁燃料是。
③可用于防毒面具的是。
④可充入霓虹灯内且通电时会发出有色光的是。
-
(2) 固定和利用二氧化碳能有效减少空气中的温室气体。例如工业上利用CO2和NH3生产尿素,反应的化学方程式为
 ,则X的化学式为。
,则X的化学式为。
在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应,一段时间后,测得相关数据如图所示,下列说法正确的是( )

A . x=3.1
B . 该反应中甲、丁的质量变化比为14:85
C . 该反应属于分解反应
D . 乙一定是该反应的催化剂
取一定质量的CaCO3高温灼烧一定时间,测得反应后剩余固体质量为17.6g,其中钙元素的质量分数为50%,则反应放出CO2的质量为( )
A . 1.1g
B . 2.2g
C . 4.4g
D . 5g
高氯酸铵(NH4ClO4)是一种火箭推进剂。实验室加热分解高氯酸铵固体,不可能得到的物质是:( )
A . CO2
B . O2
C . H2O
D . Cl2
2019年5月,华为宣布做好了启动备用芯片的准备,硅是计算机芯片的基体材料。高温下氢气与四氯化硅反应制硅的化学方程式为 

 ,其中X的化学式为( )
,其中X的化学式为( )


 ,其中X的化学式为( )
,其中X的化学式为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
质量守恒定律的发现,对化学科学的发展作出了重要贡献。请回答问题:
-
(1) 将蔗糖隔绝空气加热只得到黑色的炭和水,可知蔗糖中含有的元素是(填元素符号),推断的依据是。
-
(2) 用质量守恒定律解释“高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小”:,写出发生反应的化学方程式。
-
(3) 如图是某同学验证质量守恒定律的实验装置(B中托盘天平略)。

上述装置能用来验证质量守恒定律的是(填字母),请从原子的角度解释质量守恒定律。
一种利用太阳能分解水的原理如图所示。下列说法错误的是( )

A . 反应I的化学方程式: B . 理论上每生成2gH2 , 同时生成32gO2
C . 反应Ⅲ中生成SO2和O2的分子个数比为2:1
D . 反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变
B . 理论上每生成2gH2 , 同时生成32gO2
C . 反应Ⅲ中生成SO2和O2的分子个数比为2:1
D . 反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变
 B . 理论上每生成2gH2 , 同时生成32gO2
C . 反应Ⅲ中生成SO2和O2的分子个数比为2:1
D . 反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变
B . 理论上每生成2gH2 , 同时生成32gO2
C . 反应Ⅲ中生成SO2和O2的分子个数比为2:1
D . 反应I、Ⅱ和Ⅲ在反应前后均有元素化合价发生改变
最近更新



