实验5 一定浓度溶液的配置 知识点题库
永州市某中学的初三化学课堂上,刘老师布置了一道计算题,题目如下:
【思考题】取100g溶质质量分数为8%的氢氧化钠溶液于烧杯中,向其中加入100g19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数.
检查作业发现,班上出现了下表所示的两种情形:
结果编号 | ① | ② |
计算结果 | 14.2% | 7.1% |
请你分析并回答:
-
(1) 你赞同的计算结果是 (填结果编号).
-
(2) 请写出该题正确计算的详细过程.
如图是甲、乙两种固体物质在水中的溶解度曲线.下列说法正确的是
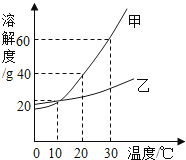
A.10℃时,甲、乙两种物质的饱和溶液浓度相同
B.使接近饱和的甲溶液变成饱和溶液可采用蒸发溶剂的方法
C.30℃时,将40g 甲物质加人50g水中,充分溶解后溶液的质量为90g
D.将10℃的两种饱和溶液升温至30℃,溶质的质量分数(填增大或减小或不变)
t℃时,分别向盛有40mL水的烧杯中加入等质量的甲、乙两种可溶性的固体物质,使其充分溶解,可观察到如图Ⅰ所示的现象. 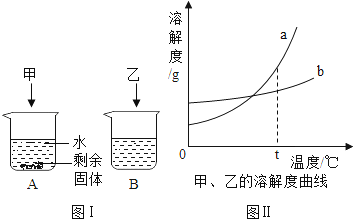
-
(1) t℃时,(填“A”或“B”)烧杯中的溶液一定是饱和溶液;两溶液中甲溶质质量分数乙溶质质量分数(填“大于”“小于”或“等于”).
-
(2) 图Ⅱ中可表示甲物质的溶解度曲线的是 (填“a”或“b”).要使A烧杯中剩余的固体继续溶解可用或的方法 .
如图是甲、石两种固体物质(不含结晶水)的溶解度曲线,下列 有关说法正确的是( )
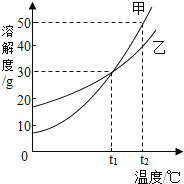
A . 温度小于t1℃时,甲的溶解度大于乙的溶解度
B . t1℃时,甲、乙溶液中溶质质量分数相等
C . 将t1℃时甲、乙两种物质的泡和溶液(没有剰余固体)升温到 t2℃,溶质的质量均不变
D . t2℃时,将甲、乙的饱和溶液分别降温至t1℃,析出的甲晶体的质量大
某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数改变,下列操作可行的是( )
A . 加入硝酸钾晶体
B . 恒温蒸发溶剂
C . 增大压强
D . 降低温度
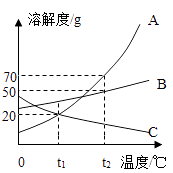
A、B、C三种固体物质的溶解度曲线如图所示,据图回答问题.
-
(1) t1℃时,A、B、C三种物质的溶解度由大到小的顺序为.
-
(2) 当A物质中混有少量B时,可用(填“降温结晶”或“蒸发结晶”)方法提纯A;
-
(3) 将t1℃时A,B,C三种物质的饱和溶液升温到t2℃,没有晶体析出的是(填字母代号);
-
(4) t1℃时,将30gA物质放入盛有100g水的烧杯中,最终所得溶液的质量为.若将烧杯内物质升温到t2℃时(不考虑水蒸发),溶液中不变的是(填序号);
A溶剂的质量 B溶液的质量 C.溶质的质量分数 D.以上都不变
-
(5) t2℃时,把A、B物质各30g加到50g水中,不能形成饱和溶液的是(填字母代号),若要使之达到饱和状态,还需要向溶液中加入 g该溶质.
下列曲线能正确表达对应的反应或过程的是( )
A . 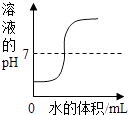 向一定量的盐酸中逐滴加水稀释
B .
向一定量的盐酸中逐滴加水稀释
B . 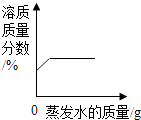 某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
C .
某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
C . 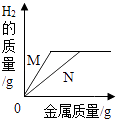 金属与一定量的稀硫酸反应,由图象可知,金属N比金属M活泼
D .
金属与一定量的稀硫酸反应,由图象可知,金属N比金属M活泼
D . 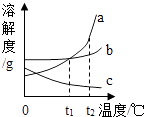 将a、b、c三种物质的饱和溶液分别由t1℃升温至t2℃时,所得溶液中溶质质量分数大小关系是:a>b>c
将a、b、c三种物质的饱和溶液分别由t1℃升温至t2℃时,所得溶液中溶质质量分数大小关系是:a>b>c
 向一定量的盐酸中逐滴加水稀释
B .
向一定量的盐酸中逐滴加水稀释
B .  某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
C .
某温度下将一定量接近饱和的KNO3溶液恒温蒸发水分
C .  金属与一定量的稀硫酸反应,由图象可知,金属N比金属M活泼
D .
金属与一定量的稀硫酸反应,由图象可知,金属N比金属M活泼
D .  将a、b、c三种物质的饱和溶液分别由t1℃升温至t2℃时,所得溶液中溶质质量分数大小关系是:a>b>c
将a、b、c三种物质的饱和溶液分别由t1℃升温至t2℃时,所得溶液中溶质质量分数大小关系是:a>b>c
某补钙剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与50g盐酸混合(药剂中其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为65.6g.

-
(1) 该品牌补钙剂每片含CaCO3的质量为多少?
-
(2) 所用盐酸中溶质的质量分数是多少?
下表是KCl和KNO3在不同温度下的溶解度。下列说法不正确的是( )
温度/ ℃ | 20 | 30 | 40 | 50 | |
溶解度/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
A . 35℃时,KCl的溶解度小于KNO3的溶解度
B . 40℃时, KCl饱和溶液的溶质质量分数为40%
C . 两种物质溶解度相等的温度在20~30℃之间
D . 50℃时,185.5g KNO3饱和溶液降温到20℃,析出53.9gKNO3 晶体
向200g溶质质量分数为10%的蔗糖溶液中加入200g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为( )
A . 10%
B . 5%
C . 2.5%
D . 0.5%
欲测定实验室一瓶久置NaCl溶液的质量分数。取117.0g待测溶液,向其中逐滴加入足量AgNO3溶液,产生沉淀的物质的量与所加硝酸银物质的量的关系如图所示。
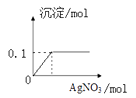
-
(1) 所得沉淀的质量是g(保留0.01g)。
-
(2) 求待测溶液中NaCl的质量分数(根据化学方程式列式计算)。
甲、乙两种固体的溶解度曲线如右图所示,下列说法中正确的是( )
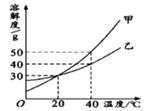
A . 甲溶液中混有少量乙,可用蒸发溶剂的方法提纯乙
B . 40℃时,分别在200g水中加入50g甲、乙,所得溶液溶质的质量分数相等
C . 20℃时,取甲、乙饱和溶液升温到40℃,甲溶液溶质质量分数大于乙溶液溶质质量分数
D . 40℃时取甲、乙等质量饱和溶液降温到20℃,乙析出比甲多
下表是KNO3 , 在不同温度时的溶解度,回答问题。
|
温度/C |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
溶解度/g |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
-
(1) 30℃时KNO3溶液的溶质质量分数的最大值是(只列出表达式)
-
(2) 90℃时,将一定质量的KNO3溶液按图示进行操作:
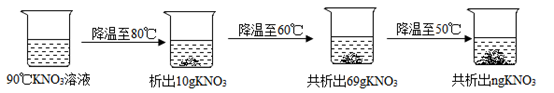
90℃时的KNO3溶液是(填“饱和“或“不饱和")溶液。图中n的数值为。
如图为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是( )

A . 30℃时,氯化铵和硫酸钠的溶解度相等
B . 40℃时硫酸钠饱和溶液中溶质和溶液质量比为 1∶3
C . 将 40℃硫酸钠的饱和溶液升高温度或降低温度都有晶体析出
D . 30℃时,将硫酸钠的饱和溶液升温至 60℃,溶质质量分数先增大后减小
下列说法正确是( )
A . 均一、稳定的液体都是溶液
B . 溶质均以离子形式分散到溶剂中
C . 硝酸钾的饱和溶液还可以溶解氯化钠
D . 饱和溶液析出晶体后溶质质量分数一定变小
如图是甲、乙、丙三种固体(均不 含结晶水)的溶解度曲线。据图回答:甲溶液中含有少量的乙时,可通过的方法提纯甲;取t2℃时甲、乙、丙三种饱和溶液各100g,均降温到t1℃,此时三种溶液中溶剂的质量大小关系为。t1℃时将65 g丙的饱和溶液加入g水,得到溶质的质量分数为10%的丙溶液。

KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是( )
| 温度/℃ | 20 | 30 | 40 | |
| 溶解度/g | KCl | 33 | 38 | 45 |
| KNO3 | 31 | 64 | 110 |
A . 40℃时,100g水中最多溶解45gKCl
B . 随着温度的升高,某饱和KCl溶液中会有固体析出
C . KNO3的溶解度始终大于KCl
D . 40℃时,某KNO3溶液中溶质的质量分数一定为 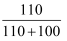 ×100%
×100%
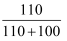 ×100%
×100%
有100g溶质质量分数为10%的食盐溶液,要使其溶质质量分数变为20%,有以下2种方法,请你进行计算:
-
(1) 可蒸发多少克水?
-
(2) 将其与溶质质量分数为25%的食盐溶液混合,需要25%的食盐溶液多少克?
如图为甲、乙两种物质( 均不含结晶水) 的溶解度曲线,下列说法正确的是( )
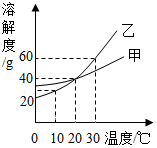
A . 通过升温可以将乙的不饱和溶液变为饱和溶液
B . 20℃时分别将甲、乙的饱和溶液蒸发相等质量的水,析出甲、乙的质量相等
C . 30℃时,乙的饱和溶液中溶质的质量分数为60%
D . 10℃时,甲、乙两种溶液中溶质的质量分数甲一定大于乙
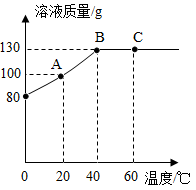
将80g物质M加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示。
-
(1) 20℃时,物质M的溶解度为g。
-
(2) 比较A,B,C点溶液的溶质质量分数大小,其中A溶液的溶质质量分数为。
-
(3) 由图可知,物质M的溶解度随温度升高而(填“增大”或“减小”)。
-
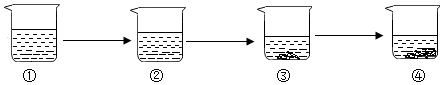
(4) 恒温蒸发物质M的溶液,现象如下图所示,烧杯(填序号)中的溶液一定是不饱和溶液。
最近更新



