第三章 金属及其化合物 知识点题库
已知A,B,C,D之间的转化关系如图所示.下列说法正确的是( )
![]()
A . 若A为Fe,D为氢气,则B一定为酸
B . 若A,D为化合物,B为水,则C一定是气体单质
C . 若A,B,C,D均为化合物,该反应一定属于复分解反应
D . 若A,B,C,D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度之比为1:2.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A . 1:1
B . 1:2
C . 1:3
D . 2:3
下列说法错误的是( )
A . 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色
B . 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制氯水,溶液变为血红色,该原溶液中一定含有Fe+
C . 加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有SO42-
D . 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管应伸入液面下
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
| 金属[ | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
下列有关三种金属的说法正确的是( )
A . 三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B . 若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C . 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D . Cu和稀盐酸不发生化学反应
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的 CO2
②向 Fe(OH)3 胶体中逐滴加入过量 H2SO4
③向 Ba(NO3)2 溶液中通入过量 SO3
④向石灰水中通入过量 CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A . ①②③⑤
B . ①④⑤
C . ①②③
D . ①③⑤
某化学兴趣小组同学对于生活中流传的“吃菠菜补铁”之说产生兴趣,设计实验进行相关探究。检索文献表明,菠菜中的铁元素以草酸亚铁的形式存在,草酸亚铁是一种淡黄色难溶于水的晶体。
-
(1) I.菠菜中铁元素含量的测定
取100g洗净晾干的新鲜菠菜,切碎后装入中,放入烘箱烧成灰烬。
-
(2) 将灰烬用25mL 2mol/L硫酸溶液溶解,加热煮沸一分钟,过滤后滴加适量H2O2溶液并稀释至100mL,取2mL加入5滴KSCN溶液。H2O2用量不可过大,否则溶液将先变红后褪色,褪色的原因是。
-
(3) 取不同浓度的[填“(NH4)2Fe(SO4)2”或“NH4Fe(SO4)2”]标准溶液各2mL,分别滴加5滴KSCN溶液,发现与步骤(2)中溶液颜色最接近的标准溶液浓度为0.4×10-3mol/L。
-
(4) 经计算可得,每100g新鲜菠菜中含有铁元素的质量约为 mg(保留1位有效数字),按人体5%吸收率,为满足每日20mg的铁元素需求,每天需要吃菠菜kg。
-
(5) Ⅱ.草酸亚铁晶体(FeC2O4·nH2O)的分解实验
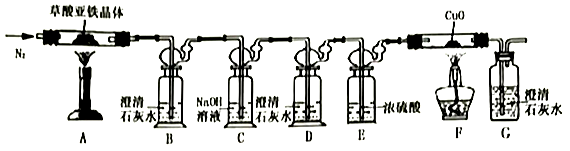
从环保角度考虑,该套实验装置的明显缺陷是。
-
(6) 实验开始后,装置B中出现浑浊证明分解产物中存在CO的现象是;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色。
-
(7) 称取7.2g草酸亚铁晶体放入装置A硬质玻璃管中,加热后(假设各步骤反应完全),测得装置A硬质玻璃管中残余固体2.88g,装置F硬质玻璃管中固体质量减轻0.64g,则草酸亚铁晶体分解的化学方程式为。
无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确是( )
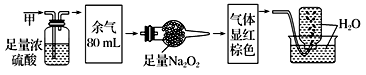
A . 甲气体肯定有NO2
B . 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C . 甲气体的组成可能为NH3、NO、NO2
D . 经过Na2O2处理后剩余气体体积大于80mL
向amolNaOH的溶液中通入bmolCO2 , 下列说法错误的是( )
A . 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a)
B . 当a<b时,发生的离子反应为:OH-+CO2=HCO3-
C . 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O
D . 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O
化学社的同学查阅资料发现,工业上曾经通过反应“3Fe+4NaOH  Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )
Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )
 Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )
Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )
A . 还原产物是钠Na和 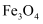 B . 用磁铁可以将Fe与
B . 用磁铁可以将Fe与 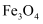 分离
C . 将生成的气体在空气中冷却可获得钠
D . 每生成1molH2 , 该反应转移的电子数约为
分离
C . 将生成的气体在空气中冷却可获得钠
D . 每生成1molH2 , 该反应转移的电子数约为 
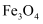 B . 用磁铁可以将Fe与
B . 用磁铁可以将Fe与 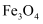 分离
C . 将生成的气体在空气中冷却可获得钠
D . 每生成1molH2 , 该反应转移的电子数约为
分离
C . 将生成的气体在空气中冷却可获得钠
D . 每生成1molH2 , 该反应转移的电子数约为 
下列各组物质充分反应后,只能得到一种气体的是( )
A . 木炭和浓硫酸共热
B . 足量的铜跟一定量的浓硝酸反应
C . Na2O2与足量的稀硫酸反应
D . 汽油在汽车发动机中燃烧后排出的气体
LiNiO2是目前在锂离子电池中得到较广泛应用的一种正极材料,因其价格较为昂贵,故回收再用意义十分重大。一种以共沉淀法从废旧电池中回收并制备超细LiNiO2的工业流程如下图所示:
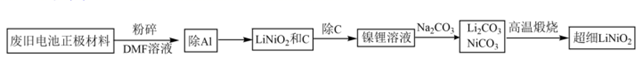
回答下列问题:
-
(1) 正极材料粉碎的目的是。
-
(2) DMF溶液无法溶解的铝单质可以用浓NaOH溶液溶解后再回收利用,写出溶解铝反应的离子反应方程式。
-
(3) 除C的方法可以是加入浓硝酸与过氧化氢的混合溶液,控制温度95℃,此时C与浓硝酸发生反应的化学方程式是;也可以常温加入稀硫酸与过氧化氢的混合溶液,将LiNiO2变为镍锂溶液然后通过(填分离方法除去C,与前者相比,通过比较反应产物来说明后者主要优点为.;试回答能否以盐酸代替硫酸并说明理由(回答“能”或“不能”并简要说明原因)。
-
(4) 高温煅烧得到1mol超细LiNiO2所转移的电子数目为。
-
(1) I.①石墨 ②液氯 ③浓盐酸 ④
 溶液 ⑤漂白粉 ⑥熔融的
溶液 ⑤漂白粉 ⑥熔融的  ⑦
⑦  ⑧硫酸氢钠晶体 ⑨水 ⑩乙醇,其中属于电解质的是,属于非电解质的是,能导电的是。(填序号)
⑧硫酸氢钠晶体 ⑨水 ⑩乙醇,其中属于电解质的是,属于非电解质的是,能导电的是。(填序号)
-
(2) Ⅱ.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
写出下列物质的化学式
A; B; C; 乙。
-
(3) 写出下列反应的化学方程式:
反应①;
反应③。
-
(4) 写出下列反应的离子方程式:
反应④;
反应⑥。
-
(1) 人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式。
-
(2) 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:3ClO−+2Fe3++10OH−=2FeO
 +3Cl−+5H2O。该反应中氧化剂是(填离子符号,下同),发生氧化反应的离子是。
+3Cl−+5H2O。该反应中氧化剂是(填离子符号,下同),发生氧化反应的离子是。
-
(3) 研究物质时会涉及物质的组成、分类、结构和性质等方面。
①NaCl属于盐类,检验其组成中所含阳离子的方法是;
②铯和钠属于同主族元素,铯原子核外有6个电子层,则铯在周期表中的位置是。请从结构角度说明铯的金属性强于钠。
将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是( )

A . 钠块只在煤油层中游动,并放出气体
B . 钠块只在水层中游动,钠块熔化,水层变红
C . 钠块在水层和煤油层界面处游动并上下跳动,钠块熔化,水层变红
D . 钠块在四氯化碳层和水层界面处游动并上下跳动,钠块熔化,水层变红
下列有关物质性质与应用的说法正确的是( )
A .  具有氧化性,可用于漂白纸浆
B . 氢氟酸具有酸性,可用于雕刻玻璃
C .
具有氧化性,可用于漂白纸浆
B . 氢氟酸具有酸性,可用于雕刻玻璃
C .  能与
能与 反应生成
反应生成 , 可作为呼吸面具中氧气的来源
D .
, 可作为呼吸面具中氧气的来源
D .  有导电性,可以用于制造光导纤维
有导电性,可以用于制造光导纤维
 具有氧化性,可用于漂白纸浆
B . 氢氟酸具有酸性,可用于雕刻玻璃
C .
具有氧化性,可用于漂白纸浆
B . 氢氟酸具有酸性,可用于雕刻玻璃
C .  能与
能与 反应生成
反应生成 , 可作为呼吸面具中氧气的来源
D .
, 可作为呼吸面具中氧气的来源
D .  有导电性,可以用于制造光导纤维
有导电性,可以用于制造光导纤维
某混合固体A可能由Fe(NO3)3、Na2CO3、AlCl3、(NH4)2SO4、Cu、SiO2组成,取固体A完成如下实验(所加试剂均过量):

下列说法错误的是( )
A . 无色气体可能为NO和CO2的混合物
B . 固体A中一定有Fe(NO3)3、AlCl3、(NH4)2SO4、Cu、SiO2 , 可能有Na2CO3
C . 取沉淀C加盐酸溶解,加硫氰化钾无明显现象,再加双氧水,溶液变红色
D . 可通过取溶液B进行焰色反应来检验固体A是否含有Na2CO3
用硫铁矿烧渣(主要成分为Fe2O3和少量SiO2)为原料制取绿矾(FeSO4·7H2O),同时对绿矾在高温下的分解产物进行实验探究。
-
(1) Ⅰ.绿矾制备流程如下:
 滤渣的主要化学成分是(填化学式)。
滤渣的主要化学成分是(填化学式)。 -
(2) 操作①、②、③是同一分离操作,该操作名称为。
-
(3) 向溶液X中加入过量的铁粉,发生的主要反应的离子方程式为。
-
(4) 若用含90%氧化铁的硫铁矿烧渣100 t,制得278 t绿矾,该工艺生产绿矾的产率为(保留三位有效数字,产率
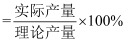 )。
)。
-
(5) Ⅱ.绿矾在高温下的分解产物实验探究
绿矾在加热至高温时会分解,为确定分解产物(已知产物中有SO3气体生成),设计如下实验装置进行了探究:

仪器G的名称为。
-
(6) 加热前,先通入一段时间氮气的目的是。
-
(7) 观察到的现象:玻璃直管中有红棕色的固体生成,B中白色固体变蓝,C中溶液褪色,请根据实验现象写出绿矾高温分解的化学方程式。
撑杆跳是奥运会比赛的项目之一、随着化学的发展,撑杆的材料不断变化,撑杆跳的高度也不断被刷新,目前已突破6.2米。下列有关说法错误的是( )
A . 19世纪撑杆通常是木制和竹制两种材质,主要成分均为天然的纤维素
B . 20世纪初撑杆材质主要是铝合金,铝合金的强度高,但熔点低于单质铝
C . 20世纪末撑杆材质主要是玻璃纤维,玻璃纤维属于无机非金属材料
D . 现在撑杆材质主要是碳纤维材料,碳纤维材料属于有机高分子材料
铬系和非铬系铜镍电镀污泥均含有Cu(Ⅱ)、Ni(Ⅱ)、Fe(Ⅱ)、Al(Ⅲ)的氢氧化物,前者还含有Cr(Ⅲ)的氢氧化物,一种综合回收铜、镍的新工艺流程如下:

已知:Cr及其化合物的性质与铝类似。
回答下列问题:
-
(1) 硫酸浸出过程中,为提高浸出速率,可以采取的措施 (写出两条)。
-
(2) “电解Ⅰ”的目的,一方面是回收铜,另一方面是,为证明这一目的是否达成,取少量“电解Ⅰ”后的溶液滴加的试剂是(填化学式)。
-
(3) “转溶”时,氢氧化钠加入量不宜过多,其原因为。
-
(4) “萃取II”时,发生的反应为
 + 2HR = CuR2 + 2
+ 2HR = CuR2 + 2 + 2NH3和
+ 2NH3和 + 2HR = NiR2+ 2
+ 2HR = NiR2+ 2 + 4NH3 , 则“反萃取Ⅱ”时含铜微粒发生反应的离子方程式为。
+ 4NH3 , 则“反萃取Ⅱ”时含铜微粒发生反应的离子方程式为。
-
(5) 整个流程中除了有机相之外,可以循环利用的物质还有NH3·H2O, (NH4)2CO3和(填化学式)。
-
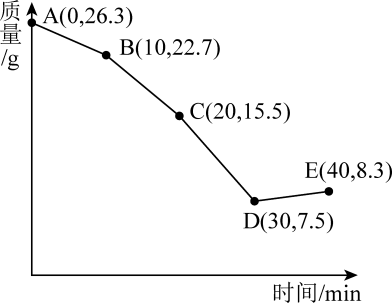
(6) NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得NiSO4·6H2O。将NiSO4·6H2O样品在900℃下,空气中进行煅烧,固体质量随时间变化如图。B点对应物质的化学式为;D点到E点反应的化学方程式为。
W、X、Y、Z、M、R是原子序数依次增大的短周期主族元素,a、b、c、d、e、f是它们组成的化合物,其中b、c、d、f是二元化合物,d是常见的温室气体,e是常见的强碱,0.01mol/L的f的水溶液pH=2。上述物质的转化关系如图所示(部分物质省略)。下列说法错误的是( )

A . 简单离子半径:R>Z>M
B . 简单气态氢化物的稳定性:R>Y>X
C . 氧化物对应的水化物的酸性:R>Y>X
D . R、X、Y、Z均可与W形成含18e-的化合物
最近更新



