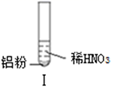
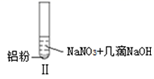
第三章 金属及其化合物 知识点题库
下列有关物质应用的说法不正确的是( )
A . 氧化铁可用来制造红色油漆和涂料
B . 生铁、普通钢和不锈钢中的含碳量依次减小
C . 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂
D . 硅是生产光纤制品的基本原料
A、B、C、D四种化合物的焰色反应均为黄色;C、D与盐酸生成一种无色无味气体E,该气体能使澄清石灰水变浑浊;D和A可反应生成C;B和E反应可生成C和另一种无色无味气体F.请回答下列问题:
-
(1) 写出E、F的化学式:E,F.
-
(2) 写出B和E反应的化学方程式:.
-
(3) 写出D和A反应的离子方程式:
下列氯化物不能用金属与盐酸反应得到的是( )
①FeCl3②FeCl2③CuCl2④MgCl2 .
A . ①②③
B . ①③
C . ②④
D . ①④
A,B,C,D,E,F六种物质的转化关系如图所示(反应条件和部分产物未标出)
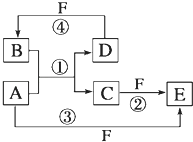
-
(1) 若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A,D反应都有红棕色气体生成,则A为,反应④的化学方程式为.
-
(2) 若A为常见的金属单质,D,F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是.
-
(3) 若A,D,F都是短周期非金属元素单质,且A,D所含元素同主族,A,F所含元素同周期,则反应①的化学方程式为.
将金属钠投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
①稀盐酸
②K2SO4溶液
③CuSO4溶液
④饱和NaOH溶液.
A . ③
B . ④
C . ③④
D . ①②
W是由A、B两种元素组成的AB 2型化合物。
-
(1) 若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为(填化学式)。
-
(2) 若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl 4 , 振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为。
②上述实验中,W与足量氯水反应的离子方程式为。
-
(3) 若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为。
②1 mol W与足量水充分反应,转移电子的物质的量为mol。
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3 , 还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
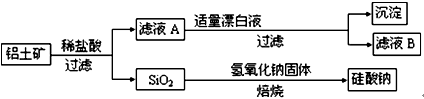
-
(1) 在滤液A中加入漂白液,所得滤液B显酸性。
①滤液A中加入漂白液的目的是:(用离子方程式表示)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
A.氢氧化钠溶液
B.硫酸溶液
C.氨水
D.二氧化碳
离子方程式为。
-
(2) 由滤液B制备少量无水AlCl3(AlCl3极易在空气中水解)涉及的操作为:、冷却结晶、(填操作名称)、洗涤。
-
(3) SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。

-
(4) 若将铝土矿溶于足量的氢氧化钠溶液,则对应的离子方程式为。
现有金属单质A,B,C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
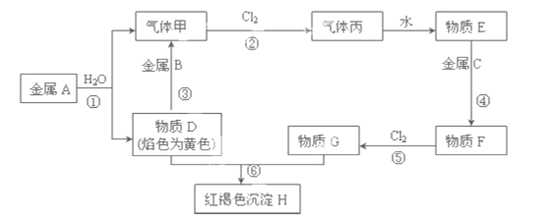
请回答下列问题:
-
(1) 物质B的化学式为:。
-
(2) 气体甲在Cl2中燃烧的现象:;
-
(3) 金属A与G的水溶液反应的化学方程式:;
-
(4) 写出下列反应的离子方程式:
③:.
⑤:.
-
(5) 将Na2O2投入到F溶液中,可以观察到的现象是:。
下列关于金属钠性质的叙述中,正确的是( )
A . 钠是密度小、硬度大、熔点高的银白色金属
B . 钠在纯净的氧气中充分燃烧,生成白色固体Na2O
C . 将金属钠放入CuSO4溶液中,可观察到大量红色的铜析出
D . 将金属钠放入水中立即熔化成小球,说明金属钠熔点低,且反应放出热量
氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
Ⅰ. 施莱兴格(Schlesinger)法

Ⅱ.高压合成法

请根据题中信息回答以下问题:
-
(1) Schlesinger 中的反应器需要附加电磁搅拌器,目的是。
-
(2) Schlesinger 的反应器中发生的化学反应方程式是。
-
(3) 采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是。
-
(4) 为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是。
-
(5) 已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由。
-
(6) 两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有。
-
(7) 使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式。
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:

资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
| M(OH)n | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.53 | 2.94 |
| Ni(OH)2 | 7.60 | 9.75 |
-
(1) 高铁酸钾具有高效消毒主要是因其具有性所致。
-
(2) 步骤③反应的离子方程式是。
-
(3) 步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是,调节pH的范围是。
-
(4) 步骤⑤发生反应的离子方程式是。
-
(5) 该流程中可循环利用的物质是:(写化学式)。
-
(6) 步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是。
-
(7) 测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L-1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O=Fe(OH)3·3H2O↓+CrO42- +OH-
2
 +2H+=
+2H+=  +H2O
+H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O该粗产品中K2FeO4的纯度为(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果(“偏高”“偏低”或“无影响”)。
某同学做如下实验
| 实验 | | | |
| 现象 | 溶液无色,试管上方呈红棕色 | 产生大量气泡,能使湿润红色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
下列说法错误的是( )
A . 实验Ⅰ试管上方呈现红棕色的原因是:2NO + O2=2NO2
B . 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生
C . 实验Ⅰ溶液中发生的反应是:Al+6H++3NO  =Al3++3NO2↑+3H2O
D . 在实验Ⅰ、Ⅱ、Ⅲ中,NO
=Al3++3NO2↑+3H2O
D . 在实验Ⅰ、Ⅱ、Ⅲ中,NO  在酸、碱及中性溶液中都被还原
在酸、碱及中性溶液中都被还原
 =Al3++3NO2↑+3H2O
D . 在实验Ⅰ、Ⅱ、Ⅲ中,NO
=Al3++3NO2↑+3H2O
D . 在实验Ⅰ、Ⅱ、Ⅲ中,NO  在酸、碱及中性溶液中都被还原
在酸、碱及中性溶液中都被还原
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
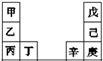
A . 金属性:甲>乙>丁
B . 原子半径:辛>己>戊
C . 丙与庚的原子核外电子数相差13
D . 乙的单质在空气中燃烧生成只含离子键的化合物
下列关于铝的叙述中,错误的是( )
A . 铝是地壳里含量最多的金属元素
B . 铝是一种比较活泼的金属
C . 在常温下,铝不能与氧气反应
D . 在化学反应中,铝易失去电子,是还原剂
下列事实与钠原子的电子跃迁无关的是( )
A . 含钠化合物的焰色为黄色
B . 钠原子光谱为不连续的线状光谱
C . 钠单质用于制作高压照明灯
D . 熔融的氯化钠能导电
中华传统文化中蕴藏丰富的化学知识。下列说法正确的是( )
A . “土鼎者……入砂于鼎中,用阴阳火候飞伏之”中“土鼎”的主要成分为硅酸盐
B . “盖此矾色绿味酸,烧之则赤……”中“矾”为五水硫酸铜
C . “硫黄能化金银铜铁,奇物”,说明硫能与Cu、Ag化合生成CuS、Ag2S
D . 《本草纲目拾遗》所载“强水”为硝酸,浓硝酸常温能溶解铝块
镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有NiOOH、Ni(OH)2、及少量Co(OH)2、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题:
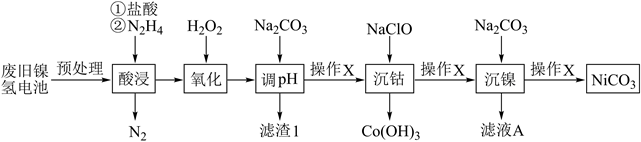
-
(1) N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。
-
(2) “氧化”过程中与Fe2+有关的离子方程式是,滤渣1主要成分是弱碱,其化学式是。
-
(3) 已知
 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)
=8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)
-
(4) 滤液A的主要溶质是;操作X是
-
(5) 用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。
已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。
将一定质量的镁铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中逐滴加入 NaOH 溶液,生成沉淀的物质的量与加入的 NaOH 溶液体积的变化关系如图所示。则下列说法错误的是( )
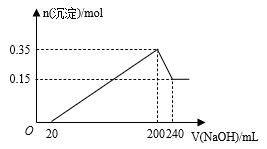
A . 镁和铝的总质量为9 g
B . 生成的氢气在标准状况下的体积为11.2 L
C . 最初20 mL NaOH溶液用于中和过量的硫酸
D . 氢氧化钠溶液的物质的量浓度为5 mol·L-1
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 常温常压下,1 mol 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
下列物质中,不能由单质之间直接化合生成的是( )
A . 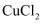 B .
B .  C .
C .  D .
D . 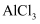
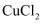 B .
B .  C .
C .  D .
D . 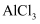
最近更新