第三节 化学键 知识点题库
氨是重要的化工原料,用途广泛.
-
(1) 合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+和CH3COO﹣构成)溶液吸收对氨合成催化剂有毒害的CO气体.
①醋酸二氨合铜所含的元素中,第一电离能最大的是.
②醋酸二氨合铜所含元素的单质,所属的晶体类型有(填序号).
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有种(不含Cu).
④铜单质为面心立方晶体,其晶胞边长a nm.列式表示铜单质的密度 g•cm﹣3 .
-
(2) BF3气体与NH3相遇立即生成一种白色晶体:BF3+NH3=F3B﹣NH3 .
①晶体F3B﹣NH3中,B原子的杂化轨道类型为.
②写出两种与BF3具有相同空间构型的阴离子、.
-
(3)
NH3可用于合成尿素、硫酸铵等氮肥.某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质.该物质在水溶液中以SO42﹣和N4H44+两种正四面体构型的离子存在.N4H44+遇碱生成一种形似白磷的N4分子.

①下列相关说法中,正确的是(填序号).
a.N4是N2的同分异构体
b.1mol N4分解生成N2 , 形成了4mol π键
c.白磷的沸点比N4高,是因为P﹣P键键能比N﹣N键大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
②画出N4H44+的结构(标明其中的配位键).
下列有关说法正确的是( )
A . 相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B . 中心原子的杂化方式取决于其配位原子的数目
C . 用金属的电子气理论能合理的解释金属易腐蚀的原因
D . H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位键
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )

A . a和b中的N原子均为sp3杂化
B . b中Ca2+的配位数为4
C . b含有分子内氢键
D . b含有共价键、离子键和配位键
下列化合物中,含有非极性共价键的离子化合物是( )
A . CaC2
B . N2H4
C . Na2S
D . NH4NO3
下列说法正确的是( )
A . NaCl固体中含有共价键
B . CO2分子中含有离子键
C .  、
、 、
、  是碳的三种核素
D .
是碳的三种核素
D .  O、
O、 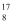 O、
O、  O含有相同的中子数
O含有相同的中子数
 、
、 、
、  是碳的三种核素
D .
是碳的三种核素
D .  O、
O、 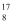 O、
O、  O含有相同的中子数
O含有相同的中子数
下列描述中正确的是( )
A . ClO2﹣的空间构型为平面三角形
B . SiF4和SO32﹣的中心原子均为sp3杂化
C . 在所有的元素中,氟的第一电离能最大
D . C2H5OH分子中共含有8个极性键,1个π键
某固体化合物的化学式NH5 , 它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
A . 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑
B . NH5中只有极性共价键的共价化合物
C . 1molNH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D . NH5中所有原子最外层均为8个电子
列说法中,正确的是( )
A . 冰融化时,分子中H﹣O键发生断裂
B . 原子晶体中,共价键越强,熔点越高
C . 分子体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D . 分子晶体中,分子间作用力越大,该物质越稳定
加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是 ( )
A . KIO3和NaCl为离子化合物,均只含离子键
B . KIO3中阳离子的结构示意图为  C . 23Na37Cl中质子数和中子数之比是8∶7
D . 次碘酸的结构式为H—O—I
C . 23Na37Cl中质子数和中子数之比是8∶7
D . 次碘酸的结构式为H—O—I
液氨是富氢物质,是氢能的理想载体。下列说法错误的是( )
A . NH3分子中氮原子的杂化方式为sp3杂化
B . [Cu(NH3)4]2+中,NH3分子是配体
C . 相同压强下,NH3的沸点比PH3的沸点低
D . NH4+与PH4+、CH4、BH4-互为等电子体
下列各项中有关判断正确的是( )
A . ①醋酸除水垢 ②石油分馏 ③煤的气化 ④海水中提取碘,过程中只涉及物理变化的是②③
B . ①CH4 和C3H8 ②O2 和O3 ③35Cl 和37Cl ④H2 和D2 , 属于同位素的微粒组是③④
C . ①金刚石熔化②氯化氢溶于水③氢氧化钾熔化④冰融化,上述过程与化学键断裂无关的是①④
D . ①酒精 ②冰醋酸 ③硝酸钾 ④醋酸钠,上述物质溶于水时会破坏水的电离平衡,且属于强电解质的仅是④
厌氧氨化法是一种新型的氨氮去除技术,下列说法中错误的是( )
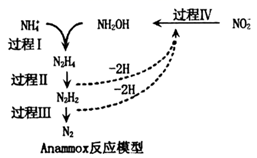
A .  中所含的质子总数为
中所含的质子总数为  B . 联氨
B . 联氨  中含有离子键和非极性共价键
C . 过程Ⅰ中,参与反应的
中含有离子键和非极性共价键
C . 过程Ⅰ中,参与反应的  与
与  的物质的量之比为1∶1
D . 过程Ⅱ中氮元素发生氧化反应,过程Ⅳ中氮元素发生还原反应
的物质的量之比为1∶1
D . 过程Ⅱ中氮元素发生氧化反应,过程Ⅳ中氮元素发生还原反应
 中所含的质子总数为
中所含的质子总数为  B . 联氨
B . 联氨  中含有离子键和非极性共价键
C . 过程Ⅰ中,参与反应的
中含有离子键和非极性共价键
C . 过程Ⅰ中,参与反应的  与
与  的物质的量之比为1∶1
D . 过程Ⅱ中氮元素发生氧化反应,过程Ⅳ中氮元素发生还原反应
的物质的量之比为1∶1
D . 过程Ⅱ中氮元素发生氧化反应,过程Ⅳ中氮元素发生还原反应
短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是前三种元素组成的二元化合物,0.01mol·L-1q溶液的pH为1.86,上述物质的转化关系如图所示。下列说法错误的是( )

A . 简单离子半径:Y>Z
B . 最简单氢化物稳定性:X>Y
C . 键角:p>n
D . 沸点:m>r
下列有机物相关说法正确的是( )
A . 氨基酸和蛋白质分子中均含有酰胺键
B . 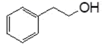 与
与 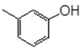 互为同系物
C . 按系统命名法,化合物
互为同系物
C . 按系统命名法,化合物  的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .
的名称是2,3,3,5,5-五甲基-4-乙基己烷
D . 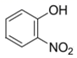 比
比 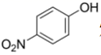 熔沸点低,是因为前者形成分子内氢键
熔沸点低,是因为前者形成分子内氢键
 的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .
的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .  比
比  熔沸点低,是因为前者形成分子内氢键
熔沸点低,是因为前者形成分子内氢键
硼化镍及镍的化合物常用作有机合成的催化剂。回答下列有关于硼和镍的问题:
-
(1) 镍的基态原子的价电子排布图(轨道式)为。
-
(2) 鉴定
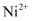 的特征反应如下:
的特征反应如下: 
①丁二酮肟中C原子的杂化轨道类型为,丁二酮肟中H、C、N、O的电负性由大到小的顺序为(用元素符号表示)。
②鲜红色沉淀二丁二酮肟合镍的晶体中不存在的作用力是。
a.σ键 b.π键 c.离子键 d.配位键 e.氢键
-
(3) ①
 与
与  的熔沸点大小关系为
的熔沸点大小关系为 
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。 ②
 的键角大于
的键角大于  的键角,解释其原因。
的键角,解释其原因。 -
(4) 硼化镁晶胞如图所示,则该晶体的化学式为;镁原子的配位数为。

顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物,碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂。NA表示阿伏加德罗常数的值。下列说法正确的是( )

A . 顺铂分子中氮原子的杂化方式是sp3
B . 碳铂分子中所有碳原子在同一平面上
C . 碳铂分子中sp3杂化的碳原子与sp2杂化的碳原子数目之比为2: 1
D . 1 mol碳铂分子中含有σ键的数目为18NA
“嫦娥五号”采回的月壤中含有的 是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )
是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )
 是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )
是一种清洁、安全的核聚变发电燃料。下列有关说法正确的是( )
A . 核聚变属于化学变化
B .  之间通过共价键形成单质分子
C .
之间通过共价键形成单质分子
C .  发电代替火电有利于实现碳达峰
D . 等物质的量的
发电代替火电有利于实现碳达峰
D . 等物质的量的 与
与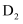 所含中子数相等
所含中子数相等
 之间通过共价键形成单质分子
C .
之间通过共价键形成单质分子
C .  发电代替火电有利于实现碳达峰
D . 等物质的量的
发电代替火电有利于实现碳达峰
D . 等物质的量的 与
与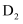 所含中子数相等
所含中子数相等
离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1-乙基-3-甲基咪唑四氟硼酸盐离子液体结构如图所示,其环状结构中存在大π键,下列相关叙述错误的是( )
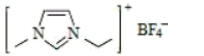
A . 该物质阳离子中至少10原子共平面
B . 该物质阴离子呈正四面体形
C . 该离子液体存在共价键、配位键、氢键
D . 该离子液体与水能够形成氢键
如图为几种晶体或晶胞的结构示意图。下列说法错误的是( )

A . 1 mol冰晶体中含有2 mol氢键
B . 金刚石属于共价晶体,其中每个碳原子周围距离最近的碳原子为4
C . 碘晶体属于分子晶体,每个碘晶胞中实际占有4个碘原子
D . 冰、金刚石、MgO、碘单质四种晶体的熔点顺序为:金刚石>MgO>冰>碘单质
在催化剂a和催化剂b的作用下,氮气分子参与反应的有关反应历程如图所示:

下列说法错误的是( )
A . 过程①为工业合成氨气
B . 过程②中参加反应的分子,化学键未完全断裂
C . 温度不变,缩小体积,过程①②的反应速率均增大
D . 上述反应包括在催化剂表面发生的反应物吸附及产物脱附等过程
最近更新



