第二章 化学反应与能量 知识点题库
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
-
(1) 上述反应Ⅰ是原子经济性反应,写出化学反应方程式。
-
(2) 在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是(填一项即可)。
-
(3) 一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
-
(4) 生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键
H-H
C-O
CO中的 C
 O
OH-O
C-H
E(kJ)
m
n
E1
x
y
根据相关数据计算拆开1molC
 O所需的能量E1=kJ。
O所需的能量E1=kJ。 -
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示:

通入H2 的一端是电池的极(填“正”或“负”),通入CO2的一端发生的电极反应式为。
 因理论比容量较高,充放电过程中材料结构稳定,有利于
因理论比容量较高,充放电过程中材料结构稳定,有利于  的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法错误的是( )
的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法错误的是( ) 
 上的电势比Zn片上的高
B . 放电时,正极反应为
上的电势比Zn片上的高
B . 放电时,正极反应为  C . 充电时,外电路中通过0.2 mol电子时,阴极质量增加6.5 g
D . 对于正极材料,充电可实现
C . 充电时,外电路中通过0.2 mol电子时,阴极质量增加6.5 g
D . 对于正极材料,充电可实现  的嵌入,放电可实现
的嵌入,放电可实现  的脱嵌
的脱嵌
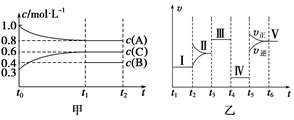
-
(1) 若t1=15 s,则t0~t1阶段的反应速率为v(C)=。
-
(2) t4时刻改变的条件为,B的起始物质的量为。
-
(3) t5时刻改变的条件为。
-
(4) 已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式。

 CO2+H2O
CO2+H2O
 X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法错误的是( )
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法错误的是( )
-
(1) 下列∆H表示物质燃烧热的是;不能表示物质中和热的是。(填字母)
A.H2(g)+
 O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1B.C(s)+
 O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
-
(2) 2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:
-
(3) 充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧1mol丁烷放出的热量为。
-
(4) 4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是mol
-
(5) 氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3 , 相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式。
 ,
,  下列说法或表示式正确的是( )
下列说法或表示式正确的是( ) 
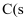 ,石墨
,石墨 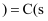 ,金刚石
,金刚石  ,该反应的焓变为负值
B . 石墨的稳定性弱于金刚石
C . 石墨和金刚石的转化是物理变化
D .
,该反应的焓变为负值
B . 石墨的稳定性弱于金刚石
C . 石墨和金刚石的转化是物理变化
D .  石墨的总键能比
石墨的总键能比  金刚石的总键能大
金刚石的总键能大 
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L−1) | 0.80 | a | 0.20 | 0.10 | 0.050 |
下列说法错误的是( )
 2C
B . 2A+2B
2C
B . 2A+2B  3C
C . A+B
3C
C . A+B  C
D . 3A+B
C
D . 3A+B  2C
2C
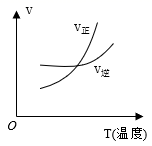
 中,下列表示该反应的反应速率最快的是( )
中,下列表示该反应的反应速率最快的是( )
 B .
B .  C .
C .  D .
D . 

| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO | |||
下列说法错误的是( )

 C . 电解一段时间,阳极区的pH减小
D . 电解一段时间,阴极、阳极消耗N2的物质的量之比为3:5
C . 电解一段时间,阳极区的pH减小
D . 电解一段时间,阴极、阳极消耗N2的物质的量之比为3:5
 B .
B . 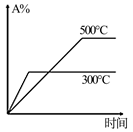 C .
C .  D .
D . 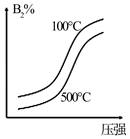

-
(1) 水是一种极弱的电解质,电解水制氢环节可以加入增强水的导电性。
-
(2) 0.1Mpa,n(H2):n(CO2)=4时,CO2加氢甲烷化各产物平衡含量随温度的变化见下图,主要副反应为:CO2(g)+H2(g)⇌H2O(g)+CO(g)∆H=+41.2kJ/mol

从上图可知,CO2加氢甲烷化反应:4H2(g)+CO2(g)⇌CH4(g)+2H2O(g)∆H<0,请从平衡常数角度解释CO2加氢甲烷化反应是放热反应的原因。
-
(3) 甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质溶液为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验,如下图所示。回答下列问题。

①甲烷燃料电池工作时,其负极的电极反应式为。
②闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是,电解NaCl溶液的总反应方程式为。
③若每个电池甲烷通入量为1L(标准状况),同时同流速且完全反应,则理论上最多能产生氯气的体积为L(标准状况)。
 N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2 , 测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )
N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2 , 测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( ) | 组别 | 温度 | 时间/min n/ mol | 0 | 10 | 20 | 40 | 50 |
| ① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
 Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( ) 

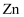 片发生还原反应
C . 氢离子在铜表面被氧化,产生气泡
D . 电子由铜片经导线流向锌片
片发生还原反应
C . 氢离子在铜表面被氧化,产生气泡
D . 电子由铜片经导线流向锌片




