第三节 化学反应的速率和限度 知识点题库
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)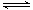 nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol·L-1·min-1 , 则上述反应中Z气体的计量系数n的值是( )
nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol·L-1·min-1 , 则上述反应中Z气体的计量系数n的值是( )
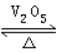 2SO3(g)△H<0是制备硫酸的重要反应.下列叙述正确的是( )
2SO3(g)△H<0是制备硫酸的重要反应.下列叙述正确的是( )

选项 | 规律 | 结论 |
A | 较强酸可以制取较弱酸 | 用亚硫酸溶液无法制取硫酸溶液 |
B | 升高温度,反应速率越快 | 常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
C | 金属越活泼,其阳离子氧化性越弱 | Fe3+的氧化性弱于Cu2+ |
D | Ksp小的沉淀易向Ksp更小的沉淀转化 | CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
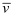 (NH3)=0.01 mol/(L•s)
B .
(NH3)=0.01 mol/(L•s)
B . 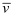 (O2)=0.00l0 mol/(L•s)
C .
(O2)=0.00l0 mol/(L•s)
C .  (NO)=0.00l0 mol/(L•s)
D .
(NO)=0.00l0 mol/(L•s)
D .  (H2O)=0.045 mol/(L•s)
(H2O)=0.045 mol/(L•s)
 B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: 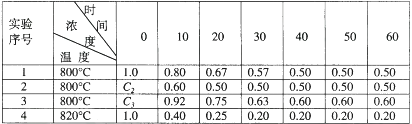
根据上述数据,完成下列填空:
-
(1) 在实验1,反应在10至20分钟时间内平均速率为mol/(L·min)。
-
(2) 在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
-
(3) 设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填“>” “<”或“=”),且c31.0mol/L(填“>” “<”或“=”)。
-
(4) 比较实验4和实验1,可推测该反应是反应(选填“吸热”、“放热”)。理由是。
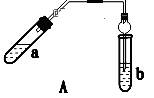
请回答下列问题:
-
(1) 步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:。
-
(2) A装置中使用球形管除起到冷凝作用外,另一重要作用是,步骤⑤中分离乙酸乙酯必须使用的一种仪器是。
-
(3) 为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验
编号
试管a中试剂
试管b中试剂
测得有机层的厚度/cm
A
3 mL乙醇、2 mL乙酸、1mL 18mol·L-1浓硫酸
饱和Na2CO3溶液
5.0
B
3 mL乙醇、2 mL乙酸
0.1
C
3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1H2SO4
1.2
D
3 mL乙醇、2 mL乙酸、盐酸
1.2
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是mL和mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是。
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为 (填字母)。
A.P2O5
B.无水Na2SO4
C.碱石灰
D.NaOH固体
-
(1) 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2, 一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。 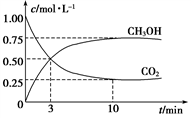
请回答:
①从反应开始到平衡,氢气的反应速率v(H2)=。
②能够说明该反应已达到平衡的是(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、和CH3OH的浓度相等
D.一定条件下,单位时间内消耗3 mol H2的同时生成1 mol CH3OH
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是。
A.加入催化剂
B.充入He(g),使体系压强增大
C.升高温度
D.将H2O(g)从体系中分离
④求此温度(T1)下该反应的平衡常数K1=(计算结果保留三位有效数字)。
⑤另在温度(T2)条件下测得平衡常数K2 , 已知T2>T1 , 则K2K1(填“>”、“=”或“<”)。
-
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
则1 mol甲醇不完全燃烧生成一氧化碳和气态水时反应的ΔH=(用含ΔH1、ΔH2的式子表示)。
-
(3) 用甲醇在熔融的碳酸盐中也可制作成燃料电池,该燃料电池的正极通入的物质是(填化学式)
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
 2Z,其平衡常数为1600
C . 增大压强使平衡向生成Z的方向移动,平衡常数增大
D . 升高温度平衡常数增大,则此反应为吸热反应
2Z,其平衡常数为1600
C . 增大压强使平衡向生成Z的方向移动,平衡常数增大
D . 升高温度平衡常数增大,则此反应为吸热反应
CO2(g)+H2(g)  CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
-
(1) 该反应的化学平衡常数表达式为K =。
-
(2) 该反应为反应(选填吸热、放热)。
-
(3) 能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
-
(4) 某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
 nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
-
(1) 前2min内用W的浓度变化表示的平均反应速率为。
-
(2) 2min末时Y的浓度为。
-
(3) 化学反应方程式中n=。
-
(4) 2min末,恢复到反应前温度,体系内压强是反应前压强的倍。
 2NO2(g),反应达到平衡的标志是 ( )
2NO2(g),反应达到平衡的标志是 ( ) ① NO、O2、NO2分子数目比是2:1:2
② 反应混合物中各组分物质的浓度相等
③ 混合气体的颜色不再改变 ④ 混合气体的密度不再改变
⑤ 混合气体的平均相对分子质量不再变化 ⑥2υ正(O2) = υ逆(NO2)
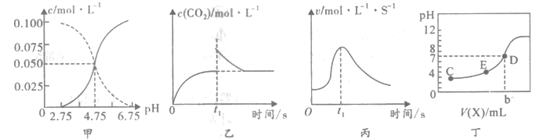
 的醋酸与醋酸钠混合溶液中
的醋酸与醋酸钠混合溶液中  、
、  与pH的关系曲线,
与pH的关系曲线,  的溶液中:
的溶液中:  B . 图乙是恒温密闭容器中发生
B . 图乙是恒温密闭容器中发生 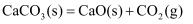 反应时,
反应时,  随反应时间变化的曲线,
随反应时间变化的曲线, 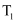 时刻改变的条件可能是缩小容器的体积
C . 图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,
时刻改变的条件可能是缩小容器的体积
C . 图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线, 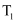 时刻溶液的温度最高
D . 图丁是常温下,用0.10mol/L NaOH溶液滴定
时刻溶液的温度最高
D . 图丁是常温下,用0.10mol/L NaOH溶液滴定 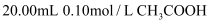 溶液。则酚酞可作本实验的指示剂,D点为滴定终点
溶液。则酚酞可作本实验的指示剂,D点为滴定终点
-
(1) 酸浸:用硫酸溶液浸取烧渣中的铁元素。若其他条件不变,下列措施中能提高单位时间内铁元素浸出率的有____(填序号)。A . 适当升高温度 B . 适当加快搅拌速率 C . 适当减小硫酸浓度
-
(2) 沉铁:取10mL“酸浸”后的滤液并加入9gNH4HCO3 , 改变氨水用量,测得铁的沉淀率随氨水用量的变化如图。
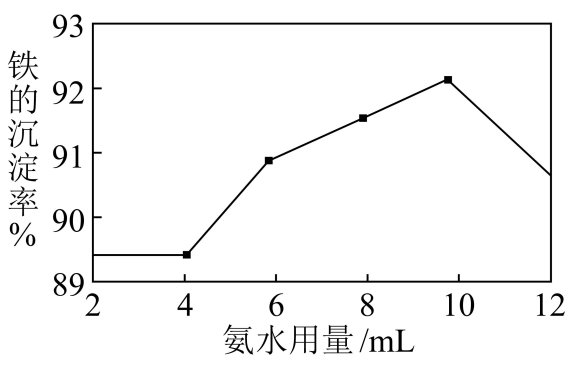
①为提高铁的沉淀率,应控制氨水用量为。②氨水用量小于4mL时,铁的沉淀率几乎无变化,其原因可能为。
-
(3) 过滤:“沉铁”后过滤,滤渣中含有FeOOH和FeCO3 , 滤液中浓度最大的阳离子是(填化学式)。
-
(4) 焙烧:FeOOH和FeCO3高温焙烧后均可得到铁红,写出FeCO3高温焙烧的化学方程式。

-
(1) CeCO3F其中Ce元素的化合价为。
-
(2) “焙烧”过程中可以加快反应速率,提高焙烧效率的方法是(写出一种即可)。
-
(3) 操作①所需的玻璃实验仪器有烧杯、。
-
(4) 上述流程中盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性;CeO2 H2O2 (填“>”,“<”)
-
(5) 写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5 mol/L,此时溶液的pH为5,则溶液中c(
 )=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。
)=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。
-
(6) Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)
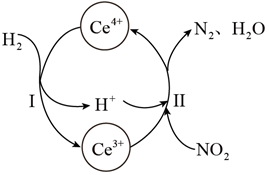
①该反应中的催化剂为(写离子符号)
②该转化过程中氧化剂与还原剂物质的量之比为。



