第三节 化学反应的速率和限度 知识点题库
一定温度下可逆反应:A(s)+2B(g)⇌2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )

-
(1) 臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:
6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H=.
-
(2) 科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为.
-
(3) O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
-
(4) 所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣•).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣•的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣•的影响.
①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ .
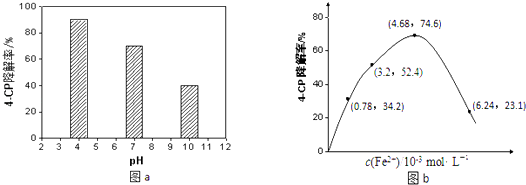
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4mol•L﹣1、c(Na2S2O8)=3.12×10﹣3 mol•L﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣•+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ•.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣•发生反应,消耗部分SO4﹣•.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3mol•L﹣1时,4﹣CP降解的平均反应速率的计算表达式为.
①铜粉 ②铁粉 ③石墨粉 ④CuO ⑤浓盐酸 ⑥碳酸钠 ⑦醋酸钠
-
(1) 在一定条件下,氮气能和水蒸气反应生成氨气和氧气2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H,与该反应相关的化学键键能数据如下:
化学键
N≡N
H—O
N—H
O=O
E(kJ/mol)
946
463
391
496
则该反应的△H=kJ·mol-1。
-
(2) 在恒容密闭容器中充入2 mol N2O5与1molO2发生反应4NO2(g)+O2(g)
 2N2O5(g)△H。
2N2O5(g)△H。 ①已知在不同温度下测得N2O5的物质的量随时间的变化如图所示,该反应的△H0(填“>”“<”或“=”)。高温下该反应能逆向自发进行,其原因是。
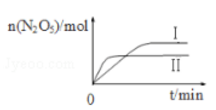
②下列有关该反应的说法正确的是(填标号)。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2 mol NO2和1molO2 , 再次达到平衡时,NO2的转化率增大
C.恒温恒容,当容器内的密度保持不变时,反应达到了平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
-
(3) N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5 , 工作原理如图所示。则硼氢化钠燃料电池的负极反应式为。

-
(4) X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol・L—1的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为。
0.01mol・L—1的溶液
X
Y
Z
W
pH
12
2
8.5
4.5
-
(5) 氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)
 NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1Ⅱ:2NO(g)+Cl2(g)
 2CNO(g) K2
2CNO(g) K2①4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1 mol Cl2 , 10min时反应Ⅱ达到平衡,测得10min内(ClNO)=7.5×10-3mol・L-1・min,则平衡时NO的转化率α1=;若其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”)。

 Z(g)
Z(g)
 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( ) ①混合气体的平均摩尔质量不再变化
②v(A)∶v(B)∶v(C)=1∶3∶4
③A,B,C的浓度不再变化
④C的体积分数不再变化
⑤A,B,C的分子数之比为1∶3∶4
⑥混合气体的密度不再变化
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: | 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
请回答下列问题:
-
(1) 该反应平衡常数表达式为K=;ΔH0(选填“>”、“<”或“=”)。
-
(2) 830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若测得反应初始至6s内A的平均反应速率v(A)=0.005mol·L-1·s-1 , 则此时A的转化率为;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率(选填“增大”、“减小”、“不变”)。
-
(3) 判断该反应是否达到平衡的依据为______(填正确选项的字母)。A . c(A)不随时间改变 B . 气体的平均摩尔质量不随时间改变 C . 压强不随时间改变 D . 单位时间里生成C和D的物质的量相等
 2CO(g),下列说法错误的是( )
2CO(g),下列说法错误的是( )
 Ni(CO)4(g),下列判断正确的是( )
Ni(CO)4(g),下列判断正确的是( )
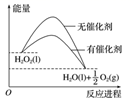

 2NH3 , 该反应为放热反应。下列说法正确的是( )
2NH3 , 该反应为放热反应。下列说法正确的是( )
-
(1) 碳还原法发生反应的化学方程式为C(s)+2NO(g)
 N2(g)+CO2(g)。能使化学反应速率加快的措施有(填序号,下同),其中属于增大活化分子百分含量的是。
N2(g)+CO2(g)。能使化学反应速率加快的措施有(填序号,下同),其中属于增大活化分子百分含量的是。①增加C的物质的量②定容密闭容器中继续充入NO③在反应器中加入NaOH溶液④升高反应温度⑤缩小容器体积
-
(2) 向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如表所示:
时间/min
浓度/(mol•L-1)
物质
0
10
20
30
NO
1.00
0.68
0.50
0.50
N2
0
0.16
0.25
0.25
CO2
0
0.16
0.25
0.25
①10~20min内,N2的平均反应速率v(N2)=。
②在30min时向容器中加入合适催化剂,v(正),v(逆)。(填“增大”“减小”或“不变”)



