课题1 化工生产过程中的基本问题 知识点题库
-
(1) 晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=﹣989.2kJ•mol﹣1 , 有关键能数据如下表:
化学键
Si﹣O
O=O
Si﹣Si
键能kJ•mol﹣1
x
498.8
176
已知1molSi中含2molSi﹣Si键,1molSiO2中含4molSi﹣O键,则x的值为.
-
(2) 假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是 .A . 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 B . 硅的来源丰富,易于开采,且可再生 C . 硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制 D . 寻找高效新催化剂,可以使反应SiO2+2C
 Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
Si+2CO↑在常温下发生,是硅能源开发利用的关键技术
-
(3) 工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJ•mol﹣1 , 生成的HCl通入100mL 1mol•L﹣1的NaOH溶液恰好完全被吸收,则上述制备纯硅的反应过程中(填“吸收”或“释放”)的热量为 kJ.
①锌粒与稀H2SO4反应制取H2
②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳
④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解
⑧钢铁制品生锈的反应.
 O2(g)⇌SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
O2(g)⇌SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
-
(1) Ⅰ→Ⅱ的反应是(填“吸热”,“放热”)反应.
-
(2) c为KJ.
-
(3) 图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 .A . △H随着b的增大而增大 B . △H随着b的增大而减小 C . △H随着b的减小而增大 D . △H不随b的变化而变化
-
(4) 图中的d+e﹣b=KJ.
①101kPa时,2C(s)+O2(g)=2CO(g)△H=﹣221kJ•mol﹣1
②稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ•mol﹣1
下列结论正确的是( )
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ·mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
 2CO2(g)+N2(g)△H=-46.8kJ·mol-1 , 可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-46.8kJ·mol-1 , 可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
-
(1) Ⅰ.2NO(g)+O2(g)
 2NO2(g) △H1=-113.0 kJ·mol-1
2NO2(g) △H1=-113.0 kJ·mol-1 Ⅱ.2SO2(g)+O2(g)
 2SO3(g) △H2
2SO3(g) △H2Ⅲ.NO2(g)+SO2(g)
 SO3(g)+NO(g) △H3=-41.8 kJ·mol-1
SO3(g)+NO(g) △H3=-41.8 kJ·mol-1△H2=。
-
(2) 在 100℃时,将1mol NO2与1 mol SO2的混合气体置于2L绝热恒容密闭容器中发生反应Ⅲ。
①2min末测得 SO3的物质的量为 0.2 mol,则 v(SO3)=;
②能够判断此反应达到平衡的标志是;
A.
 B. 混合气体的密度保持不变
B. 混合气体的密度保持不变D. 混合气体的颜色保持不变 C. 体系的压强保持不变
③正反应的反应速率随时间变化的趋势如图所示,b点后正反应速率降低的原因:。

-
(3) 在 400℃和 650℃条件下,分别向两个相同体积的密闭容 了器中充人 2 mol NO2 和 2 mol SO2 , 发生反应:NO2(g)+ SO2(g)
 SO3(g)+NO(g)△H<0,实验得出两容器中SO2与 NO 的物质的量随时间的变化关系如图所示。已知气体分压=总压×气体的物质的量分数,用气体分压代替浓度计算的平衡常数叫压强平衡常数(Kp),曲线ad对应的容器中平衡后总压为px kPa,曲线bc 对应的容器中平衡后总压为py kPa。
SO3(g)+NO(g)△H<0,实验得出两容器中SO2与 NO 的物质的量随时间的变化关系如图所示。已知气体分压=总压×气体的物质的量分数,用气体分压代替浓度计算的平衡常数叫压强平衡常数(Kp),曲线ad对应的容器中平衡后总压为px kPa,曲线bc 对应的容器中平衡后总压为py kPa。 
①曲线bc 表示的是 650℃条件下相关物质的物质的量的变化曲线,其判断依据是;②400℃条件下平衡常数 Kp=。
-
(4) Li/SO2电池以 LiBr-AN(乙腈)、液态 SO2为电解质溶液,放电时有白色的连二亚硫酸锂(Li2S2O4)沉淀生成。
①放电时正极的电极反应式为;
②锂电池必须在无水环境中使用的原因是(用化学方程式表示)。
-
(1) 氧化亚铜制备
①用CuO与Cu在900℃高温烧结可得Cu2O。
已知:2Cu(s)+O2(g)=2CuO(s) △H1=-314kJ•mol-1
2Cu2O(s)+O2(g)=4CuO(s) △H2=-292kJ•mol-1
则反应CuO(s)+Cu(s)=Cu2O(s)的△H3=kJ•mol-1。
②肼还原制备Cu2O。方法如下:将3~5mL浓度为20%N2H4(肼)水溶液倒入50mL高浓度醋酸铜水溶液中,使Cu2+被还原,并产生氮气。将生成的Cu2O沉淀用水、乙醇和乙醚洗涤。
生成Cu2O的离子方程式为;肼不宜过量,可能的原因是。
③电解法制备Cu2O流程如图:

电解时阳极生成Cu2Cl2的电极反应式为,Cu2Cl2在溶液中生成Cu2O的化学方程式为。
-
(2) Cu2O与ZnO组成的催化剂可用于催化合成甲醇[CO(g)+2H2(g)
 CH3OH(g)]。将H2和CO按
CH3OH(g)]。将H2和CO按  =2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示:
=2的投料比充入1L恒容密闭容器中,在一定条件下发生上述反应,CO的平衡转化率与温度的关系如图所示: 
①随着温度的升高,该反应的平衡常数(填“增大”“减小”或“不变”);图中压强由大到小的顺序为。
②提高CO的平衡转化率除温度和压强外,还可采取的措施是。
-
(1) 工业上一般采用下列两种反应合成甲醇:
反应 I:CO ( g) + 2H2(g)⇌CH3OH ( g) ΔH1
反应 II:CO2(g)+ 3H2( g)⇌CH3OH(g) + H2O( g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“II”)
②下表所列数据是反应 I 在不同温度下的化学平衡常数 (K ):
温度
250℃
300℃
350℃
K
2. 041
0. 270
0. 012
由表中数据判断ΔH10 (填“>”、“< ”或“=”)。
③某温度下 ,将 2mol CO 和6 mol H2充入 2 L 的密闭容器中,充分反应,达到平衡后,测得 n (CO)=0.4 mol,则CO的转化率为 ,此时的温度为℃(从上表中选择)。
-
(2) 已知在常温常压下 :
①2CH3OH (l)+ 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1 275.6kJ• mol-1
②2CO (g) + O2(g) = 2CO2(g) ΔH= - 566.0kJ• mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
-
(3) 用如图所示的装置电解K2SO4溶液同时制备H2SO4和 KOH 溶液, II 中装入K2SO4溶液( a、b 是离子交换膜),下列有关分析正确的是_________。
 A . I 区生成H2SO4 B . a 是阴离子交换膜 C . II 区中的K+进入 I 区 D . III区溶液的 pH 会升高
A . I 区生成H2SO4 B . a 是阴离子交换膜 C . II 区中的K+进入 I 区 D . III区溶液的 pH 会升高

-
(1) A试管中发生反应的化学方程式为。
-
(2) B试管中的现象。
-
(3) C试管中的现象是。
-
(4) 湿碱棉团的作用是。

反应i:I2(g)=2I(g) ΔH1
反应ii:H2(g)+2I(g)=2HI(g) ΔH2
其能量与反应过程的关系如图所示:

已知:对于基元反应aA+bB=cC+dD,其速率方程为v正=kca(A)· cb(B)
结合图回答下列问题:
-
(1) ΔH10(填“>”或“<”)。
-
(2) 反应i逆反应的活化能为kJ/mol(用含a、b、c的代数式表示)。
-
(3) 决定总反应速率快慢的是(填“反应i”或“反应ii”)
-
(4) 各步反应速率方程如表,其中k1、k2、k3、k4分别为v1正、v1逆、v2正、v2逆的速率常数,且仅与温度有关。
反应i
反应ii
v1正=k1c(I2)
v1逆=k2c2(I)
v2正
v2逆=k4c2(HI)
①表中v2正=。
②实验测得总反应速率v=kc(I2)c(H2),则k=(用仅含k1 , k2 , k3的代数式表达)。
-
(5) 将等物质的量的I2和H2置于预先抽真空的特制1L密闭容器中,加热到1500K,起始总压强为400kPa;平衡后,总压强为450kPa。体系中存在如下反应关系:
I2(g)
 2I(g) Kp1=100kPa
2I(g) Kp1=100kPaI2(g)+H2(g)
 2HI(g) Kp2
2HI(g) Kp21500K平衡体系中I(g)的分压为kPa、Kp2=(保留到小数点后2位)。

 排放力争2030年前达到峰值,力争2060年前实现碳中和。回答下列问题:
排放力争2030年前达到峰值,力争2060年前实现碳中和。回答下列问题:
-
(1) 有利于实现“碳达峰、碳中和”的是____(填标号)。A . 燃煤脱硫 B . 粮食酿酒 C . 风能发电 D . 石油裂化
-
(2)
 催化重整可以得到合成气(
催化重整可以得到合成气(
 和
和
 ),对“碳达峰、碳中和”具有重要意义。
),对“碳达峰、碳中和”具有重要意义。
①
 催化重整反应:
催化重整反应:
 , 有利于提高
, 有利于提高
 平衡转化率的条件是(填标号)。
平衡转化率的条件是(填标号)。A.低温高压 B.高温低压 C.高温高压 D.低温低压
②某温度下,在体积为
 的容器中加入
的容器中加入
 以及催化剂进行重整反应,达到平衡时
以及催化剂进行重整反应,达到平衡时
 的转化率是
的转化率是
 , 其平衡常数为
, 其平衡常数为
 。
。③反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应

消碳反应


75
172
活化能(kJ·mol-1)
催化剂X
43
72
催化剂Y
33
91
由上表判断,催化剂XY(填“优于”或“劣于),理由是。
④在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图1所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是(填标号)。

A.K积减小、K消增加 B.v积减小、v消增加
C.K积、K消均增加 D.v消增加的倍数比v积增加的倍数大
⑤在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[(CO2)]-0.5(k为速率常数)。在
 一定时,不同
一定时,不同
 下积碳量随时间的变化趋势如图2所示,则
下积碳量随时间的变化趋势如图2所示,则
 从大到小的顺序为。
从大到小的顺序为。
-
(1)
 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示:
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示:
反应:

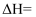 。
。 -
(2) 反应Ⅰ进行时,同时发生反应:
 在1L恒容密闭容器中充入
在1L恒容密闭容器中充入 和
和 , 一定温度下,达到平衡时,
, 一定温度下,达到平衡时, ,
,  ,
,  物质的量分数为%。(计算结果保留1位小数)
物质的量分数为%。(计算结果保留1位小数)
-
(3) 乙烯是合成工业的重要原料,一定条件下可发生反应:
 。
。①分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,经相同时间测得
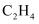 体积分数与温度的关系如图所示:
体积分数与温度的关系如图所示:
在催化剂甲作用下,图1中M点的速率

 (填“>”、“<”或“=”),根据图1所给信息,应选择的反应条件为。
(填“>”、“<”或“=”),根据图1所给信息,应选择的反应条件为。②一定温度下,该反应正逆反应速率与
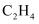 、
、 的浓度关系:
的浓度关系: ,
,  (
(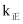 、
、 是速率常数),且
是速率常数),且 或
或 的关系如图所示,向恒容密闭容器中充入一定量
的关系如图所示,向恒容密闭容器中充入一定量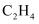 , 反应进行m分钟后达平衡,测得
, 反应进行m分钟后达平衡,测得 , 该温度下,平衡常数K=(用含a、b的计算式表示,下同),用
, 该温度下,平衡常数K=(用含a、b的计算式表示,下同),用 表示的平均反应速率为
表示的平均反应速率为 。
。
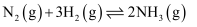
 ;下列有关合成氨反应的说法正确的是( )
;下列有关合成氨反应的说法正确的是( )
 时,反应达到平衡状态
C . 反应中每消耗
时,反应达到平衡状态
C . 反应中每消耗 转移电子的数目约等于
转移电子的数目约等于 D . 密闭容器中充入
D . 密闭容器中充入 和
和 充分反应放出
充分反应放出 热量
热量



