课题1 化工生产过程中的基本问题 知识点题库

填写下列空白:
(1)已知0.5mol甲烷和0.5mol水蒸气在t℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量.该反应的热化学方程式是:
(2)上述流程中,工业上分离H2、CO2合理的方法是
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行 ,目的是 ;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况
CH3CH2CH2CH3(g)+  O2(g)═4CO2(g)+5H2O(l)△H=﹣2 878kJ/mol
O2(g)═4CO2(g)+5H2O(l)△H=﹣2 878kJ/mol
(CH3)2CHCH3(g)+  O2(g)═4CO2(g)+5H2O(l)△H=﹣2 869kJ/mol
O2(g)═4CO2(g)+5H2O(l)△H=﹣2 869kJ/mol
下列说法正确的是( )
 正丁烷与异丁烷的能量大小关系如图
B . 正丁烷的稳定性大于异丁烷
C . 异丁烷转化为正丁烷的过程是一个放热过程
D . 异丁烷分子中的碳氢键比正丁烷的多
正丁烷与异丁烷的能量大小关系如图
B . 正丁烷的稳定性大于异丁烷
C . 异丁烷转化为正丁烷的过程是一个放热过程
D . 异丁烷分子中的碳氢键比正丁烷的多
 SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
-
(1) 在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJ·mol−1和283.0 kJ·mol−1 , 则CO(g)的ΔHm0=。
-
(2)
合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =−81.0 kJ·mol−1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)=。
②已知:
温度/K
398
498
…
平衡常数(K)
126.5
K1
…
则:K1126.5(填“>”或“<”);其判断理由是。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
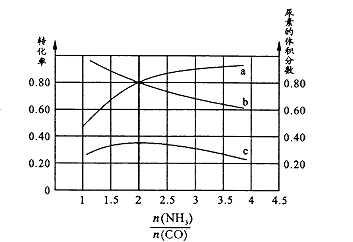
若图中c表示平衡体系中尿素的体积分数,则a表示的转化率。
当
 =时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
=时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。 -
(3) 通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 mol·L−1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为(已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
Co3+氧化HCOOH的离子方程式为;
忽略体积变化,电解前后Co2+的浓度将(填“增大”、“减小”或“不变”)。
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
-
(1) 我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。A . 煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用 B . 煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠 C . 煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重 D . 通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
-
(2) 乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为。
-
(3) 由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ•mol−1(b>0)的反应中,反应物具有的总能量(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要(填“放出”或“吸收”)能量才能转化为生成物。
-
(4) 关于用水制取二次能源氢气,以下研究方向错误的是________________A . 组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源 B . 设法将太阳光聚焦,产生高温,使水分解产生氢气 C . 寻找高效催化剂,使水分解产生氢气,同时释放能量 D . 寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
-
(5) 已知下列两个热化学方程式:
A、2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•mol-1
B、C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ•mol-1 , 其中,能表示燃烧热的热化学方程式为(A或B),其燃烧热为。

下列说法或表示式正确的是( )
 CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2 , 在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示,下列说法正确的是( )
CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2 , 在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示,下列说法正确的是( ) 
 O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
 C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
C . 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D . CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
-
(1) CO是煤气的主要成分,可与水蒸气反应生成氢气:CO(g)+ H2O(g)⇌CO2(g)+H2(g)∆H。 查阅资料得出相关数据如表:
温度/℃
400
500
平衡常数K
9
5.3
①反应升高到一定温度时,反应将不能正向进行,由此判断该反应的∆S(填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.2 mol CO(g)和0.2mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为。
-
(2) 将1 mol CH4和2 mol H2O(g)通入容积为10 L的恒容密闭容器中,发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。CH4的平衡转化率与温度、压强的变化关系如图所示。

①200 ℃时,该反应的平衡常数K=。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是。
③压强:p1 (填“>”“<”或“=”)p2。
 Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
 C . 若增大压强,则物质Y的转化率减小
D . 若升高温度,X的体积分数增大,则该反应是放热反应
C . 若增大压强,则物质Y的转化率减小
D . 若升高温度,X的体积分数增大,则该反应是放热反应
-
(1) 已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1 =-907.0 kJ/mol
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的正反应活化能为E正 kJ/mol,则其逆反应活化能为kJ/mol(用含E正的代数式表示)。
5N2(g) +6H2O(g)的正反应活化能为E正 kJ/mol,则其逆反应活化能为kJ/mol(用含E正的代数式表示)。 -
(2) 在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g)
 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。 
①工业上应选择催化剂(填“甲”或“乙”)。
②M点是否为对应温度下NO的平衡转化率,判断理由是。温度高于210℃时,NO转化率降低的可能原因是。
-
(3) 已知:NO2(g) +SO2(g)
 NO(g)+SO3(g) △H<0.向密闭容器中充入等体积的NO2和SO2 , 测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
NO(g)+SO3(g) △H<0.向密闭容器中充入等体积的NO2和SO2 , 测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。 
①ab两点体系总压强pa与pb的比值
 =;同一温度下图象呈线性变化的理由是。
=;同一温度下图象呈线性变化的理由是。②温度为T2时化学平衡常数Kp=,T1T2(填“>”、“<”或“=”)。
 ,则铵盐加热时都能产生
,则铵盐加热时都能产生  B .
B .  通入硝酸钡溶液中出现白色沉淀,则
通入硝酸钡溶液中出现白色沉淀,则  通入
通入  也能出现白色沉淀
C . 蔗糖中滴入浓硫酸会炭化,则纸片上滴入浓硫酸也会炭化
D .
也能出现白色沉淀
C . 蔗糖中滴入浓硫酸会炭化,则纸片上滴入浓硫酸也会炭化
D .  能与氢氟酸发生反应,则
能与氢氟酸发生反应,则  也能与
也能与 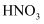 发生反应
发生反应
-
(1) I二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂,对臭氧层无破坏作用。
利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
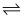 CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol②2CH3OH(g)
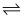 CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol③CO(g)+H2O(g)
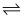 CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol总反应:3H2(g)+3CO(g)
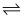 CH3OCH3(g)+CO2(g)的△H =,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,下列选项中可以采取的措施是:。(填序号)
CH3OCH3(g)+CO2(g)的△H =,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,下列选项中可以采取的措施是:。(填序号)a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
-
(2) 已知上述(1)中反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
物质
CH3OH
CH3OCH3
H2O
物质的量/(mol)
4.0
6.0
6.0
①比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)。
②若在此密闭容器中开始加入21molCH3OH,则达到平衡时c(CH3OH)=;
-
(3) II.工业废水中常含有一定量的Cr2O
 和CrO
和CrO
 , 它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
, 它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为:

流程第①步存在平衡:2CrO
 +2H+
+2H+
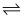 Cr2O
Cr2O
 +H2O,能说明第①步反应达平衡状态的是____(填序号)A . Cr2O
+H2O,能说明第①步反应达平衡状态的是____(填序号)A . Cr2O 和CrO
和CrO
 的浓度相同
B . 2v(Cr2O
的浓度相同
B . 2v(Cr2O
 )=v(CrO
)=v(CrO
 )
C . 溶液的颜色不变
)
C . 溶液的颜色不变
-
(4) 流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq)常温下Cr(OH)3的溶度积Ksp=10-32 , 当c(Cr3+)降至10-5mol/L时溶液的pH为。
Cr3+(aq)+3OH-(aq)常温下Cr(OH)3的溶度积Ksp=10-32 , 当c(Cr3+)降至10-5mol/L时溶液的pH为。
-
(5) 方法2:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是。
 在水中能形成
在水中能形成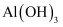 胶体,可用作净水剂
B . 金刚石是自然界中硬度最大的物质,不能与氧气发生反应
C . 浓硫酸具有强氧化性,不能用于干燥
胶体,可用作净水剂
B . 金刚石是自然界中硬度最大的物质,不能与氧气发生反应
C . 浓硫酸具有强氧化性,不能用于干燥 D . 将
D . 将 通入品红溶液中,品红溶液褪色后加热恢复原色;将
通入品红溶液中,品红溶液褪色后加热恢复原色;将 通入溴水中,溴水褪色后加热也能恢复原色
通入溴水中,溴水褪色后加热也能恢复原色



