课题3 纯碱的生产 知识点题库

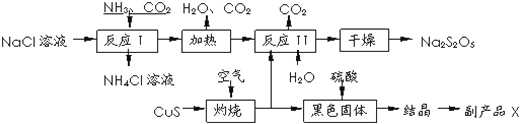
已知:反应Ⅱ包含2NaHSO3⇌Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为: .
(2)“灼烧”时发生反应的化学方程式: .
(3)已知Na2S2O5与稀硫酸反应放出SO2 , 其离子方程式为: .
(4)反应I时应先通的气体为 副产品X的化学式是 .生产中可循环利用的物质为 (填化学式)
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 .检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸.
-
(1) 卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS);
-
(2) 氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
①图1中的中间产物C是 ,D .(写化学式);
②装置乙中发生反应的化学方程式为 ;
-
(3) 联合制碱法对氨碱法的改进,其优点是 ;
-
(4) 有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾.请结合2图的溶解度(S)随温度变化曲线,分析说明是否可行? .
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3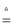 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号).
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
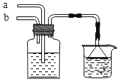
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
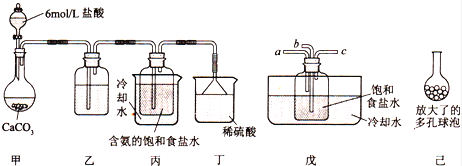
试回答下列有关问题:
①乙装置中的试剂是 .②丁装置的作用是 .
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验.
①实验时,须先从a管通入 气体(填气体分子式),再从b管通入 气体(填气体分子式).
②有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量:称取1.840g小苏打样品(含少量NaCl),配制成250mL溶液,取出25.00mL用0.1000mol•L﹣1盐酸滴定,消耗盐酸21.50mL.
①实验中所需要的定量仪器除滴定管外,还有 .②样品中NaHCO3质量分数为 .
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 .(选填“偏高”、“偏低”或“不受影响”)
-
(1) (一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠.写出相关离子方程式.
-
(2)
(二)实验装置:所需实验药品和装置如图所示:
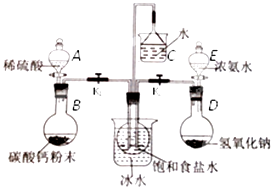
(三)实验步骤:
组装好装置,然后应该进行的操作是.
-
(3) 中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入).仪器A的名称是,选择用稀硫酸而不用稀盐酸的好处是.
-
(4) 先打开(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶.大约20分钟左右时,观察到饱和食盐水上方有现象时,再打开(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.
-
(5) (四)纯碱制备:
上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g.
-
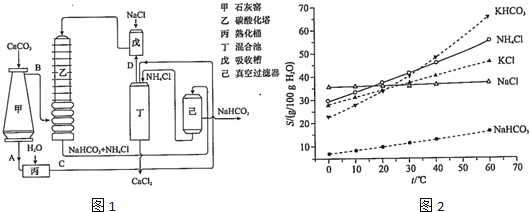
(1) 工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、.
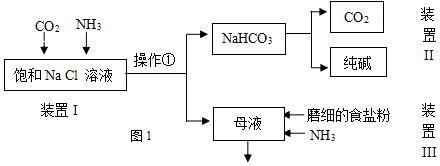
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:
已知:几种盐的溶解度
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20℃,100gH2O时)
36.0
21.7
9.6
37.2
-
(2) ①写出装置I中反应的化学方程式.
②从平衡移动角度解释该反应发生的原因.
③操作①的名称是.
-
(3) 写出装置II中发生反应的化学方程式.
-
(4) 请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.
-
(5) 该流程中可循环利用的物质是
-
(6) 制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
-
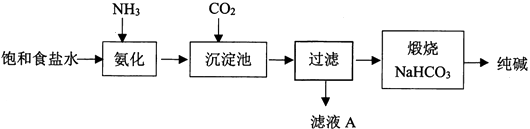
(1) 写出CO2的电子式。
-
(2) 用离子方程式表示纯碱工艺中HCO3-的生成。
-
(3) 工业生产时先氨化再通CO2 , 顺序不能颠倒,原因是。
-
(4) 滤液A中最主要的两种离子是。
-
(5) 某小组设计如下实验分离滤液A中的主要物质。打开分液漏斗活塞,一段时间后,试管中有白色晶体生成,用化学原理解释白色晶体产生的原因。
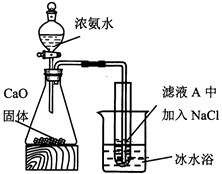
-
(6) 某纯碱样品因煅烧不充分而含少量NaHCO3 , 取质量为m1的纯碱样品,充分加热后质量为m2 , 则此样品中碳酸氢钠的质量分数为。

-
(1) 工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

已知:几种盐的溶解度
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20℃,100gH2O时)
36.0
21.7
9.6
37.2
-
(2) ①写出装置I中反应的化学方程式。
②从平衡移动角度解释该反应发生的原因。
③操作①的名称是。
-
(3) 写出装置II中发生反应的化学方程式。
-
(4) 请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用。
-
(5) 该流程中可循环利用的物质是。
-
(6) 制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是。
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量
 浓度
B . 生成NaHCO3
C . 析出NH4Cl晶体
D . 降低
浓度
B . 生成NaHCO3
C . 析出NH4Cl晶体
D . 降低  浓度
浓度
-
(1) 侯氏制碱法制得的“碱”的化学式:。
-
(2) 写出碳酸氢钠在水中的电离方程式:。
-
(3) 写出除去
 固体中混有的
固体中混有的  杂质的化学方程式:。
杂质的化学方程式:。
-
(4) 请将方程式补充完整:
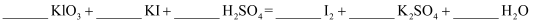
反应Ⅰ: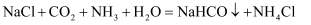
反应Ⅱ: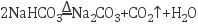
下列制取少量 的实验原理和装置能达到实验目的的是( )
的实验原理和装置能达到实验目的的是( )
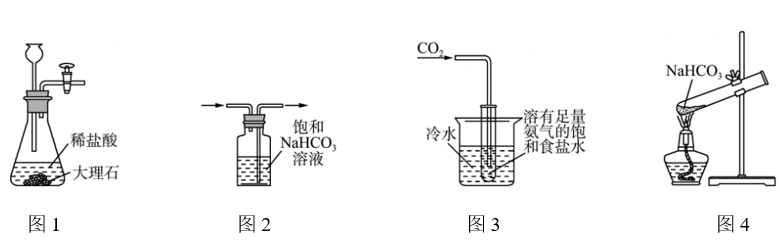
 B . 除去
B . 除去 中
中 C . 制取
C . 制取 D . 制取
D . 制取
 溶解度比NaCl、
溶解度比NaCl、 、
、 、
、 都小的性质,运用
都小的性质,运用 的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是( )
 , B气体是CO2
B . 第Ⅲ步得到的晶体是发酵粉的主要成分
C . 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D . 第Ⅳ步操作的主要过程有溶解、蒸发、结晶
, B气体是CO2
B . 第Ⅲ步得到的晶体是发酵粉的主要成分
C . 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D . 第Ⅳ步操作的主要过程有溶解、蒸发、结晶



