课题3 纯碱的生产 知识点题库
属于联合制碱法优点的是 ( )
A . 氨和二氧化碳由合成氨厂提供
B . 母液可回收氯化铵
C . 氯化钠的利用率达90%以上
D . 以上全是
下列化学工业中,未涉及原料循环使用的是( )
A . 侯德榜制碱法
B . 索尔维制碱法
C . 工业电解饱和食盐水
D . 工业炼铁
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )

A . A气体是NH3 , B气体是CO2
B . 把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片
C . 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D . 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
以下关于氨碱法与联合制碱法的认识,不正确的是( )
A . 氨碱法生产纯碱的原料便宜易得,步骤简单,是最早的制碱工艺
B . 联合制碱法又称侯氏制碱法,是侯德榜在氨碱法的基础上改造形成的
C . 在联合制碱法中,氯化钠的利用率比氨碱法中的高
D . 联合制碱法避免了氨碱法中对氯化钙的处理
联合制碱法生产纯碱的工艺流程如下图所示。下列说法正确的是( )

A . 氨化与碳酸化的先后顺序可以交换
B . 操作I和操作II是两种不同的分离方法
C . 该工艺流程中循环利用的物质是NH3和CO2
D . 流程中的“一系列操作”包括通氨气、冷却、加食盐
关于侯氏制碱法,下列表述错误的是( )
A . 食盐利用率比较高
B . 实验条件下NaHCO3的溶解度较小
C . 析出NaHCO3固体后的母液中只含氯化铵
D . 在饱和食盐水中应先通入氨气,再通入二氧化碳
某同学根据工业制碱原理在实验室里制备少量的Na2CO3 , 依次经过制取氨气,制取NaHCO3 , 分离NaHCO3 , 分解NaHCO3四个步骤。下列图示装置和原理正确的是( )
A . 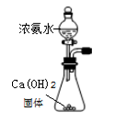 制取氨气
B .
制取氨气
B .  制取NaHCO3
C .
制取NaHCO3
C . 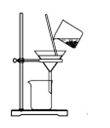 分离NaHCO3
D .
分离NaHCO3
D . 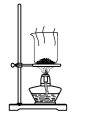 分解 NaHCO3
分解 NaHCO3
 制取氨气
B .
制取氨气
B .  制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  分解 NaHCO3
分解 NaHCO3
实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3 , 反应原理为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,下列说法不正确的是( )

A . 通过活塞K可控制CO2的流速
B . 装置b、d依次盛装饱和Na2CO3溶液、稀硫酸
C . 装置c中含氨的饱和食盐水提高了CO2吸收效率
D . 反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A . 华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B . 用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C . 国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D . 侯氏制碱法的工艺过程中应用了物质溶解度的差异
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:

-
(1) 上述流程图中,可循环利用的物质是。
-
(2) 流程Ⅰ后过滤所得滤液中含有的溶质有。
-
(3) 流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为。
-
(4) 用一个化学反应方程式表示出流程Ⅱ中发生的总反应。
-
(5) 工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是。
下列选项所示的物质间转化不能实现的是( )
A . 饱和NaCl(aq)  NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
B . NaBr(aq)
Na2CO3(s)
B . NaBr(aq) 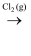 Br2(aq)
Br2(aq)  HBr(aq)
C . MgCl2(aq)
HBr(aq)
C . MgCl2(aq)  Mg(OH)2(s)
Mg(OH)2(s)  MgO(s)
D . KI(aq)
MgO(s)
D . KI(aq) 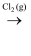 I2(aq)
I2(aq)  FeI3(aq)
FeI3(aq)
 NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
B . NaBr(aq)
Na2CO3(s)
B . NaBr(aq) 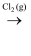 Br2(aq)
Br2(aq)  HBr(aq)
C . MgCl2(aq)
HBr(aq)
C . MgCl2(aq)  Mg(OH)2(s)
Mg(OH)2(s)  MgO(s)
D . KI(aq)
MgO(s)
D . KI(aq) 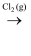 I2(aq)
I2(aq)  FeI3(aq)
FeI3(aq)
下列物质的制备与工业生产相符的是( )
A . NH3  NO
NO 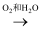 HNO3
B . NaCl(aq)
HNO3
B . NaCl(aq)  Cl2
Cl2 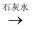 漂白粉
C . MgCl2(aq)
漂白粉
C . MgCl2(aq)  无水MgCl2
无水MgCl2  Mg
D . 饱和NaCl(aq)
Mg
D . 饱和NaCl(aq) 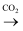 NaHCO3
NaHCO3  Na2CO3
Na2CO3
 NO
NO 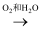 HNO3
B . NaCl(aq)
HNO3
B . NaCl(aq)  Cl2
Cl2 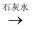 漂白粉
C . MgCl2(aq)
漂白粉
C . MgCl2(aq)  无水MgCl2
无水MgCl2  Mg
D . 饱和NaCl(aq)
Mg
D . 饱和NaCl(aq) 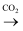 NaHCO3
NaHCO3  Na2CO3
Na2CO3
某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:
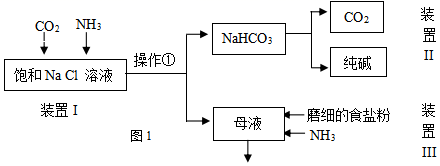
已知:几种盐的溶解度
|
物质 |
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
|
溶解度 |
36.0 |
21.7 |
9.6 |
37.2 |
-
(1) ①写出装置I中反应的化学方程式。
②操作①的名称是。
-
(2) 写出装置II中发生反应的化学方程式。
-
(3) 该流程中可循环利用的物质是。(填化学式)
-
(4) 用该纯碱配制的溶液中可能含有Cl- , 请设计实验检验含有Cl-:。
氯化钠是化学工业的最基本原料之一,被称为“化学工业之母”。下列有关说法正确的是( )
A . “制钠”:海水为原料制得精盐,再电解氯化钠溶液制备钠
B . “氯碱工业”:采用“阴离子交换膜”电解槽电解饱和食盐水获得氯气和烧碱
C . 根据氯碱工业的原理,若电解氯化钾溶液,则反应为  D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
 D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
侯德榜先生是我国现代化学工业的开拓者和奠基者,他于1943年发明的侯氏制碱法工艺流程如图所示:
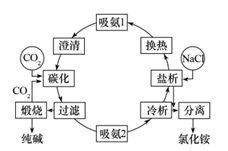
下列说法错误的是( )
A . 该工艺中循环利用的物质为CO2和NH3
B . 该工艺主产品是纯碱,副产品为NH4Cl
C . “过滤”后的母液中,n(Na)小于n(Cl)
D . 该工艺中涉及化合反应、复分解反应和分解反应
某实验小组在实验室中模拟侯德榜制碱法利用饱和食盐水、 为原料制取纯碱流程如下图所示:
为原料制取纯碱流程如下图所示:
 为原料制取纯碱流程如下图所示:
为原料制取纯碱流程如下图所示: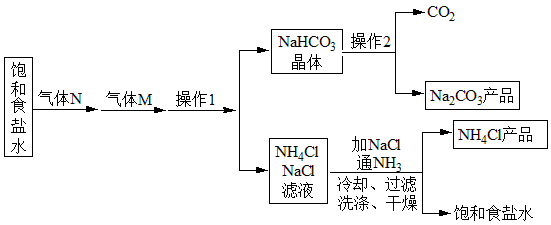
 仪器R
仪器R
下列说法正确的是( )
A . 气体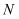 为
为 , 先通
, 先通 有利于吸收
有利于吸收 B .
B . 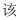 流程中只有饱和食盐水可以循环使用
C . 操作
流程中只有饱和食盐水可以循环使用
C . 操作 为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作
为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作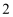 为灼烧,实验室中常在上图仪器
为灼烧,实验室中常在上图仪器 中进行
中进行
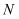 为
为 , 先通
, 先通 有利于吸收
有利于吸收 B .
B .  流程中只有饱和食盐水可以循环使用
C . 操作
流程中只有饱和食盐水可以循环使用
C . 操作 为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作
为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作 为灼烧,实验室中常在上图仪器
为灼烧,实验室中常在上图仪器 中进行
中进行
降低能耗是氯碱工业发展的重要方向。
-
(1) 我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
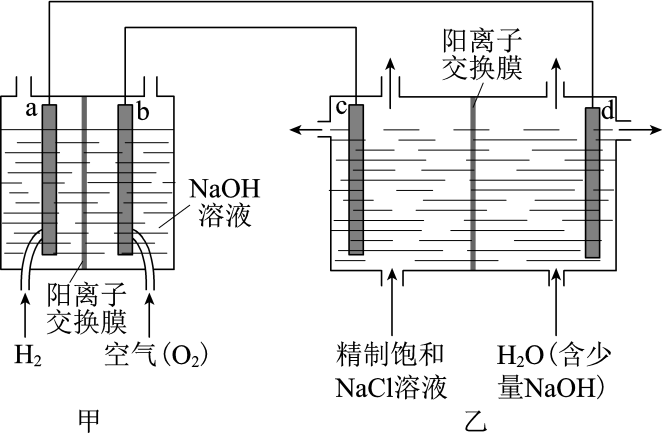
①a极为(填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为。
③下列说法正确的是。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:。
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2 , 产生O2的电极反应式为。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
-
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为。
下列科学家中,为我国化学工业作出重大贡献的是( )
A . 钱学森
B . 侯德榜
C . 华罗庚
D . 李四光
侯德榜为我国化工事业的发展贡献了毕生精力,是中国化学工业的开拓者,近代化学工业的奠基人之一,是世界制碱业的权威。某研究性学习小组感动于侯德榜先生热爱祖国、自强不息的精神,在学习了工业“侯氏制碱法”的原理后(NaCl+NH3+ CO2 + H2O=NaHCO3↓+NH4Cl)。决定重走科学家探索之路,进行了如下的研究:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取NaHCO3的过程呢?
[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置。已知浓氨水遇生石灰会产生大量的NH3。
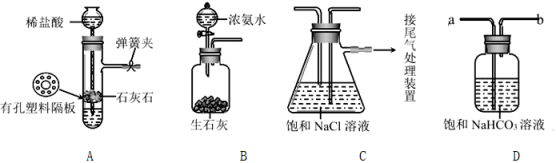
请回答下列问题:
-
(1) 检验装置A气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若,说明装置不漏气。
-
(2) 实验室用石灰石(杂质既不溶于水也不与稀盐酸反应)和稀盐酸反应制取二氧化碳。反应的化学方程式为。
-
(3) 装置D是连接在装置A与装置C之间的气体净化装置,进气口是(填 “a”或“b”),装置D的作用是除去气体。
-
(4) 实验时先向饱和NaCl溶液中通入较多的NH3(溶液显碱性),再通入足量的CO2 , 其原因是(填标号)。
①使CO2更易被吸收②NH3比CO2更易制取③CO2的密度比NH3大
-
(5) 用的操作方法将生成的NaHCO3晶体从溶液中分离出来。[得出结论]利用“侯氏制碱法”在实验室可以制取NaHCO3。
侯德榜是我国著名爱国科学家,他放弃国外的优厚待遇,毅然回国报效祖国,为我国的化学工业辛勤奋斗了一生。他发明的侯氏制碱法在国际上获奖,振奋了中国人民的志气。侯氏制碱法的工业流程如下图:实验室模拟工业上侯氏制碱原理制备纯碱,下列操作未涉及的是( )
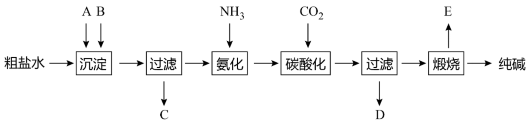
A .  B .
B . 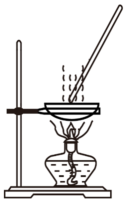 C .
C .  D .
D . 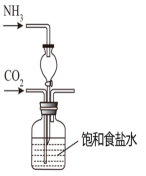
 B .
B .  C .
C .  D .
D . 
最近更新



