课题3 纯碱的生产 知识点题库
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3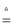 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O

-
(1) 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
-
(2) 某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
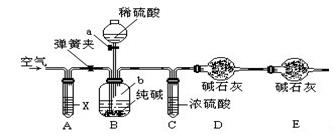
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
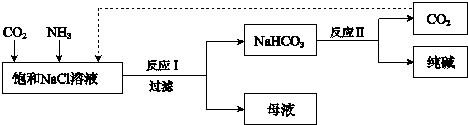
(Ⅰ)乙装置中的试剂是 , 其作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有 .
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入气体,说明原因 .
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
-
(3) 碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为 .
-
(4) 请你再设计出一种实验室制取少量碳酸氢钠的方法: .
低温
已知反应I为:NaCl+CO2+NH3+H2O  NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
-
(1) 工业生产中,制备NH3的化学方程式是
-
(2) 海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42﹣等离子.
①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中,过滤;
c.向滤液中,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是.
-
(3) 反应II的化学方程式是.
-
(4) 制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2 . 则样品中纯碱的质量分数是 %(保留1位小数).
-
(1) 该过程的化学方程式:.
-
(2) 加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是.

-
(3) 得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入振荡,观察
现象:溶液中产生大量白色沉淀;
结论:.
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入,振荡,观察
现象:;
结论:样品中含有NaHCO3 .
步骤三:将步骤二的浊液过滤,取滤液于试管C中,
振荡,观察
现象:;
结论:.
-
(4) 某同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为(用含a、b的代数式表示)
-
(1) Ⅰ.实验室欲模拟侯氏制碱法来制备纯碱Na2CO3 , 需要的CO2气体用下图中的装置A来制备.优点是可随用随停.如图中的装置B、C、D中与A具有相同工作原理也可制备CO2气体的是(填写字母).

Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCL2溶液,将所得沉淀(填操作名称)、洗涤、烘干、称量、计算、洗涤沉淀的具体操作是
方案二:把一定量的样品与足量硫酸反应后,用如图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用.如图装置中实验仪器a的名称是.

-
(2) 方案三:利用如图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
①按图连接装置,并检查气密性;
②准备称得盛有碱石灰的干燥管D的质量为33.4g;
③准备称得6g纯碱样品放入容器b中;
④打开分液漏斗a的胶塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g.
1)若④⑤两步的实验操作太快,则会导致测定结果(填“偏大”或“偏小”).
2)装置A中试剂X应选用.
3)E装置的作用是.
4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量百分数为
(结果保留一位小数).
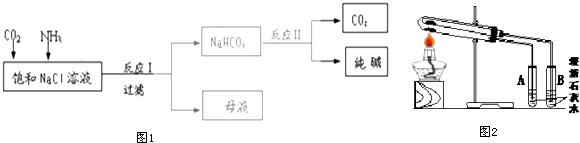
已知NaHCO3在低温下溶解度较小.反应Ⅰ为:NaCl+CO2+NH3+H2O  NaHCO3↓+NH4Cl,NH4Cl和浓碱液反应可产生NH3:
NaHCO3↓+NH4Cl,NH4Cl和浓碱液反应可产生NH3:
-
(1) 上述工艺流程中可以循环利用的物质是.
-
(2) 反应Ⅱ的化学方程式为.
-
(3) 若在Ⅱ中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了以下探究.如图2所示,取加热了t1min的NaHCO3样品加在大试管的底部,另取等质量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.开始加热一段时间后,若试管(填“A”或“B”)中会出现浑浊现象,说明Ⅱ中灼烧的分解不完全;若开始时两试管中加入的固体质量相等,充分加热后,B试管中产生的沉淀的质量是A中的2倍(假设澄清石灰水足量),则反应Ⅱ中NaHCO3的分解率为.(分解率=已分解的质量/原物质的总质量)
-
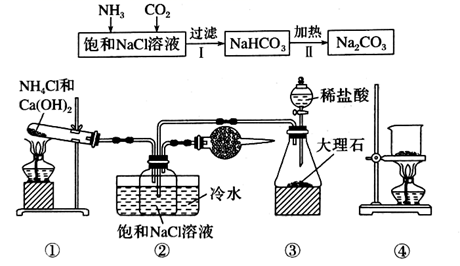
(1) Ⅰ.以下是实验室模拟制碱原理制取Na2CO3的流程图。

下表是四种物质在100g水中不同温度的溶解度
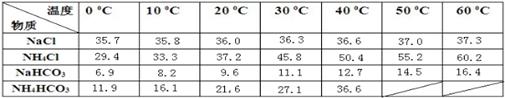
粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→→→→b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
-
(2) 向饱和食盐水中先通入,后通入,生成固体A的化学方程式为
-
(3) Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把6g样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后得到5g固体。
洗涤沉淀的具体操作是。
-
(4) 根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为(结果保留小数点后一位)。
-
(5) 方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
已知:碱石灰为氢氧化钠和氧化钙的混合物。
实验开始前应进行的操作是。
-
(6) 仪器a的名称为,装置A中试剂X应选用。
-
(7) 装置E的作用是。
 的过程中完成乙烯氯化,下列叙述不正确的是( )
的过程中完成乙烯氯化,下列叙述不正确的是( ) 
 的再生
C . 理论上每生成
的再生
C . 理论上每生成  ,可得到
,可得到  D . 过程Ⅲ中的反应是
D . 过程Ⅲ中的反应是 
 模拟工业制纯碱
B .
模拟工业制纯碱
B . 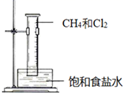 甲烷的取代反应
C .
甲烷的取代反应
C .  实验室制乙炔
D .
实验室制乙炔
D .  除去氯气中的氯化氢
除去氯气中的氯化氢
 邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
B .
邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
B .  邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
C .
邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
C .  邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
D .
邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
D .  邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
-
(1) 食盐溶于水发生电离,其电离方程式。
-
(2) 2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为(用化学方程式表示)。
-
(3) 事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是(结合化学方程式解释)。
-
(4) 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
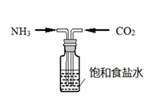
①饱和食盐水中先通入NH3达饱和,再通入CO2至饱和,会析出碳酸氢钠晶体,写出该反应的化学方程式。将碳酸氢钠溶于水,溶液显性。(填“酸”、“碱”或“中”)。
②碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的化学方程式为。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者后者(填“>”、“<”或“=”)。
③除去碳酸钠固体中碳酸氢钠的反应的化学方程式为。
 在接触室被氧化为
在接触室被氧化为 ,
,  则在吸收塔用水吸收得到浓硫酸
D . 工业上用焦炭直接还原氧化铁冶炼金属铁
则在吸收塔用水吸收得到浓硫酸
D . 工业上用焦炭直接还原氧化铁冶炼金属铁
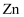 和
和 溶液制备
溶液制备
-
(1) 用Na2CO3固体配制100mL0.200mol·L−1Na2CO3溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
②计算需要Na2CO3固体的质量是g。
③下列情况中,会使所配溶液浓度偏高的是(填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
-
(2) 探究Na2CO3与盐酸的反应。向0.200mol·L−1Na2CO3溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:
 +H+=
+H+=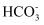 、。
、。
-
(3) 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3溶于水生成碱,与酸反应生成盐,如NH3+HNO3=NH4NO3。
ii.有关物质的溶解度(20℃)
物质
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度/g
36.0
21.7
9.6
37.2
①煅烧炉中发生的是分解反应,反应的化学方程式为。
②沉淀池中发生的是复分解反应,反应的离子方程式为。
-
(1) 某研究小组甲模仿侯德榜制备纯碱,反应原理如下:
 即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度(填较小或较大)的碳酸氢钠。欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是(选装置)。
即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度(填较小或较大)的碳酸氢钠。欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是(选装置)。
A.
 B.
B. C.
C. D.
D.
反应的化学方程式是。
-
(2) 某研究小组乙在探究
 的性质实验时,发现
的性质实验时,发现 样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性
样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性 溶液褪色,同时放出氧气。小组成员查阅资料表明,
溶液褪色,同时放出氧气。小组成员查阅资料表明, 与水反应还可生成
与水反应还可生成 。
。
①
 与水反应生成
与水反应生成 的反应是否属于氧化还原反应(填是、否)。
的反应是否属于氧化还原反应(填是、否)。②写出
 与水反应的离子反应方程式。
与水反应的离子反应方程式。③完成并配平该反应的离子方程式: _
 +_
+_ +_
+_ =_
=_ +_
+_ +_
+_



