第二章 化学反应速率和化学平衡 知识点题库
 CH30H(g),现在容积均为1 L的a、b、c三个密闭容器中分别充入1molCO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。
CH30H(g),现在容积均为1 L的a、b、c三个密闭容器中分别充入1molCO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。
下列说法正确的是( )
-
(1) 已知氢气的燃烧热△H=﹣285.5kJ•mol﹣1 , 则电解水的热化学方程式为
-
(2) 在298K、101kPa下,2SO2(g)+O2(g)⇌2SO3(g)△H=﹣198kJ•mol﹣1 , 则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=。
-
(3) 25℃时,下表为一些难溶电解质的相关数据:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
开始沉淀时的pH
5.8
4.1
2.0
完全沉淀时的pH
8.3
6.4
3.2
常温下,除去酸性CuCl2溶液中含有的少量FeCl2 , 其操作步骤为:
①应先加入(填试剂名称),发生的离子反应方程式为
②再加入CuO,调节溶液的pH在范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。
-
(1) 25℃时,50mL0.1mol/L醋酸中存在下述平衡:(用离子方程式表示)
-
(2) 若分别作如下改变,对上述平衡有何影响?
加入少量冰醋酸,平衡将移动(正向、逆向),溶液中c(H+)将(增大、减小、不变);
-
(3) 加入一定量蒸馏水,平衡将移动(正向、逆向),溶液中c(H+)将(增大、减小、不变)
-
(4) 加入少量0.1mol/L盐酸,平衡将移动(正向、逆向),溶液中c(H+)将(增大、减小、不变)
-
(5) 加入20mL0.10mol/LNaCl,平衡将移动(正向、逆向),溶液中c(H+)将(增大、减小、不变)

 mL•s-1
D . 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
mL•s-1
D . 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
|
化学式 |
HF |
HCN |
H2CO3 |
|
电离常数 |
Ka=3.5×10-4 |
Ka=5.0×10-10 |
Ka1=4.3×10-7 , Ka2=5.6×10-11 |
-
(1) c (H+)相同的三种酸,其酸的浓度从大到小为。
-
(2) 若HCN酸的起始浓度为0.01mol/L,平衡时c(H+)约为mol/L。若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是。
-
(3) 中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则ab (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2 , 则n1n2 (填“大于”、“小于”或“等于”)
-
(4) 向NaCN中通入少量的CO2 , 发生的离子方程式为。
 SiN4(s)+6CO(g)ΔH>0。根据化学平衡移动原理,理论上该反应的反应条件应为( )
SiN4(s)+6CO(g)ΔH>0。根据化学平衡移动原理,理论上该反应的反应条件应为( )

下列说法正确的是( )
 和甲醇
和甲醇
 HCO3ˉ+OHˉ。下列说法正确的是( )
HCO3ˉ+OHˉ。下列说法正确的是( )
 不变
不变
-
(1) 573K时,CO2能与H2在催化剂下转化生成CH3OH。已知:
ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH=+41.2kJ·mol-1ⅱ.CO(g)+2H2(g)
 CH3OH(g)ΔH=-90.4kJ·mol-1
CH3OH(g)ΔH=-90.4kJ·mol-1请写出CO2与H2反应生成CH3OH(g)的热化学方程式。
-
(2) 用Ni作催化剂,在一定的温度和压强下,CO2与CH4发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+274.3kJ·mol-1。
2CO(g)+2H2(g)ΔH=+274.3kJ·mol-1。 下列反应条件有利于提高CH4平衡转化率的是 (填正确答案标号)。
A . 适当升高温度 B . 降温同时加压 C . 增大CO2的量 D . 选择更合适的催化剂 -
(3) 某化学实验小组将1molCH4与1molCO2充入1L的恒容密闭容器中,使其发生反应CH4(g)+CO2(g)
 2CO(g)+2H2(g),测得CH4和CO2的平衡转化率随温度变化的关系如图所示。
2CO(g)+2H2(g),测得CH4和CO2的平衡转化率随温度变化的关系如图所示。 ①1200K之前CO2的平衡转化率大于CH4可能的原因是。
②923K时,该反应在10min达到平衡,则0~10min内CH4的平均反应速率为 mol·L-1·min-1。

-
(4) 2014年我国科学家成功实现甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等高值化学品。某化学研究室将2molCH4充入1L的密闭容器中,在单中心铁的催化作用下,CH4主要转化为C2H4 , 同时还有C6H6(g)、H2生成,反应达到平衡时测得n(C2H4)=0.6mol、C6H6(g)=0.05mol,则反应2CH4(g)
 C2H4(g)+2H2(g)的平衡常数K=(计算结果保留一位小数)。
C2H4(g)+2H2(g)的平衡常数K=(计算结果保留一位小数)。
-
(5) 利用电化学装置可实现将CH4和CO2两种分子转化为常见化工原料,其原理如图所示:

①多孔电极a为(填“阴极”或“阳极”)。
②若生成的C2H6和C2H4的体积比为1:1,则多孔电极b发生的反应为。
③当生成C2H6和C2H4各0.1mol时,转化的CH4和CO2的总体积在标准状况下是L。
 或lg
或lg  ,下列叙述正确的是( )
,下列叙述正确的是( ) 
 HCO3-+OH-的平衡常数为1.0×10-7.6
B . 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C . 曲线m表示pH与 -lg
HCO3-+OH-的平衡常数为1.0×10-7.6
B . 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C . 曲线m表示pH与 -lg  的变化关系
D . Ka1(H2CO3)的数量级为10-7
的变化关系
D . Ka1(H2CO3)的数量级为10-7

已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s)  2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
反应II:2Al2O3(s)+9C(s)  Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
反应III:Al2O3(s)+Al4C3(s)  6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3
请回答下列问题:
-
(1) 工业上电解法冶炼铝的化学方程式为。
-
(2) △H3=。
-
(3) 图1中石墨与Al2O3混合物加热至150 min时容器内温度约为。
-
(4) 从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是。
-
(5) 由图2可得1650 K时,反应I的平衡常数K=。
-
(6) 下列说法错误的是___。A . 图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动 B . 图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度 C . 图2中T≥1700K时体系中一定还发生了其他副反应 D . 综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
-
(7) 请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图。

2SO2(g)+O2(g)  2SO3 △H= -196 kJ/mol
2SO3 △H= -196 kJ/mol
回答下列问题:
-
(1) 某温度下,SO2平衡转化率α与体系总压强p的关系如图(a)所示。

①将2.0 mol SO2和 1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于
②平衡状态由A变到B时,平衡常数KA KB(填“>” “<”或“=”)。
-
(2) 在密闭容器中,原料气进料比例按SO2(g)、O2(g)和N2(g) 起始的物质的量分数分别为7.5%、10.5%和 82%,在0.5.MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图(b)所示。

①2.5MPa时,反应平衡常数K(500℃)K(600℃) (填“>” “<”或“=”)。
②反应在5.0MPa、550℃时的SO2平衡转化率α=,判断的依据是。
③影响SO2平衡转化率α的因素有。
 的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是( )
的反应热和化学平衡常数分别为∆H和K,∆H<0,下列说法正确的是( )
 C . 其他条件不变,增大
C . 其他条件不变,增大  的量,∆H和K均增大
D . 相同温度时反应
的量,∆H和K均增大
D . 相同温度时反应  的反应热和化学平衡常数为-2∆H和
的反应热和化学平衡常数为-2∆H和 
 eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( ) 
 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在
磁性材料在很多领域具有应用前景,其制备过程如下(各步均在  氛围中进行):
氛围中进行): ①称取  ,配成
,配成  溶液,转移至恒压滴液漏斗中。
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入  溶液。
溶液。
③持续磁力搅拌,将  溶液以
溶液以 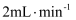 的速度全部滴入三颈烧瓶中,100℃下回流3h。
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在  干燥。
干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
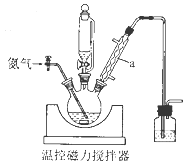
回答下列问题:
-
(1) 仪器a的名称是;使用恒压滴液漏斗的原因是。
-
(2) 实验室制取
 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为,对应的装置为(填标号)。
有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为,对应的装置为(填标号)。 可供选择的试剂:
 、
、 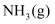 、
、  、
、  、饱和
、饱和  、饱和
、饱和 
可供选择的发生装置(净化装置略去):

-
(3) 三颈烧瓶中反应生成了Fe和
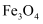 ,离子方程式为。
,离子方程式为。
-
(4) 为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A . 采用适宜的滴液速度 B . 用盐酸代替KOH溶液,抑制
 水解
C . 在空气氛围中制备
D . 选择适宜的焙烧温度
水解
C . 在空气氛围中制备
D . 选择适宜的焙烧温度
-
(5) 步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。
-
(6) 该实验所得磁性材料的产率为(保留3位有效数字)。
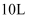 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:
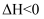 , 一段时间后达到平衡。反应过程中测定的数据如下表:
, 一段时间后达到平衡。反应过程中测定的数据如下表:
|
t/min |
2 |
4 |
7 |
9 |
|
n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是( )
 的平均速率
的平均速率  B . 该温度下此反应的平衡常数
B . 该温度下此反应的平衡常数  C . 其他条件不变,再充入
C . 其他条件不变,再充入 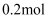 Z ,平衡时 X 的体积分数不变
D . 其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
Z ,平衡时 X 的体积分数不变
D . 其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
 2CO2+N2 , 280℃的情况下,反应5 min后NO的浓度为0.8×10-3 mol/L。为了验证温度对化学反应速率的影响,某同学设计了两组实验,如表所示。下列说法错误的是( )
2CO2+N2 , 280℃的情况下,反应5 min后NO的浓度为0.8×10-3 mol/L。为了验证温度对化学反应速率的影响,某同学设计了两组实验,如表所示。下列说法错误的是( ) | 实验编号 | t/℃ | NO的初始浓度/(mol/L) | CO的初始浓度/(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 350 | a | 5.80×10-3 | 82 |