第二章 化学反应速率和化学平衡 知识点题库
①CO(g)+2H2(g)⇌CH3OH(g)△H1
②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
-
(1) 已知反应①中相关的化学键键能数据如下:
化学键
H﹣H
C﹣O
C═O
H﹣O
C﹣H
E/(kJ•mol﹣1)
436
343
1076
465
413
由此计算△H1=kJ•mol﹣1;已知△H2=﹣58kJ•mol﹣1 , 则△H3=kJ•mol﹣1 .
-
(2) 反应①的化学平衡常数K表达式为.
 HCl(aq)+HClO(aq)达到平衡时,有关说法正确的是()
HCl(aq)+HClO(aq)达到平衡时,有关说法正确的是()
-
(1) 组成镁铝碱式碳酸盐的三种非金属元素的原子半径从小到大的顺序是。碳原子最外层电子排布式是,铝原子核外有种能量不同的电子。
-
(2) 将MgaAlb(OH)c (CO3)d·x H2O表示成氧化物的形式:2aMgO·bAl2O3·2dCO2·()H2O;
-
(3) 焦炭与石英高温下在氮气流中发生如下反应,工业上可由此制得一种新型陶瓷材料氮化硅(Si3N4):3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g) + Q (Q>0)。
Si3N4(s)+6CO(g) + Q (Q>0)。 ①该反应中,氧化产物是。若测得反应生成4.48 L CO气体(标准状况下),则转移的电子的物质的量为。
②该反应的平衡常数表达式K=;若升高温度,K值(填“增大”、“减小”或“不变”)。
③该反应的速率与反应时间的关系如图所示,t4时刻引起正逆反应速率变化的原因是(写出一种即可)。


-
(1) 已知肼的球棍模型如图所示,写出肼的电子式:。
-
(2) 已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:。
-
(3) 目前正在研发的一种肼燃料电池的结构如下图所示。
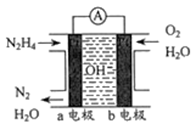
①该电池的负极是(填“a”或“b”)电极。
②写出正极的电极反应式:。
-
(4) 在1L固定体积的容器中加入0.1molN2H4 , 在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中  与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=。 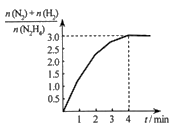
 、电离常数(Ka、Kb)、溶度积常数
、电离常数(Ka、Kb)、溶度积常数  等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是( )
等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是( )
 一定均变大
B .
一定均变大
B .  说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C . 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生
说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C . 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生  沉淀,则
沉淀,则 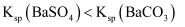 D . 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
D . 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
 zC达到平衡时,则:
zC达到平衡时,则:
-
(1) 若A,B,C都是气体,在减压后平衡正向移动,则x、y、z的关系是;
-
(2) 已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是状态;
-
(3) 若容器容积不变,加入气体B,气体A的转化率(填“增大”、“减小”,或“不变”)。
-
(4) 若容器容积不变升高温度,A的百分含量减小,则正反应是反应(填“放热”或“吸热”)。升高温度再次达到平衡,B、C的浓度之比c(B)/c(C)将
(填“增大”、“减小”或“不变”)。

根据以上信息回答下列问题:
-
(1) 生产过程中X的化学式为。
-
(2) 写出产生CuCl的离子方程式:。
-
(3) 实验探究pH对CuCl产率的影响如下表所示:
pH
1
2
3
4
5
6
7
CuCl产率/%
70
90
82
78
75
72
70
析出CuCl晶体最佳pH为 ,当pH较大时CuCl产率变低原因是 。调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是。
-
(4) 氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数
1
2
3
0.25g样品消耗硫酸铈标准溶液的体积(mL)
24.35
24.05
23.95
则样品中CuCl的纯度为 。(结果保留三位有效数字)。
-
(5) 由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)
 CuOH(s)+Cl-(aq)+H+(aq),第二步CuOH热分解的化学:方程式为。第一步CuCl水解反应的平衡常数足与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=。
CuOH(s)+Cl-(aq)+H+(aq),第二步CuOH热分解的化学:方程式为。第一步CuCl水解反应的平衡常数足与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=。
 可用于纯硅的制备。下列有关该反应的说法正确的是( )
可用于纯硅的制备。下列有关该反应的说法正确的是( )
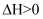 、
、 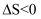 B . 该反应的平衡常数
B . 该反应的平衡常数  C . 高温下反应每生成1 mol Si需消耗
C . 高温下反应每生成1 mol Si需消耗  D . 用E表示键能,该反应
D . 用E表示键能,该反应 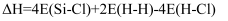

-
(1) 在同浓度Fe3+的催化下,探究浓度对H2O2分解反应速率的影响。实验装置如图所示:
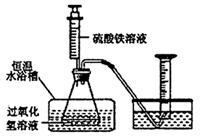
①写出H2O2溶液在Fe3+催化下分解的化学方程式;除了图中所示仪器之外,该实验还必需的仪器是。
②请写出下面表格中I、II、III的实验记录内容或数据:
实验序号
0.1mol/LFe2(SO4)3溶液的体积/mL
II
30%H2O2溶液的体积/mL
蒸馏水的体积/mL
O2的体积/mL
1
I
b
c
d
e
2
a
b
d
III
f
I=,II=,III=。
-
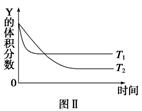
(2) 利用图1和图2中的信息,按图3装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到A瓶中气体颜色比B瓶中的(填“深”或“浅”),其原因是。
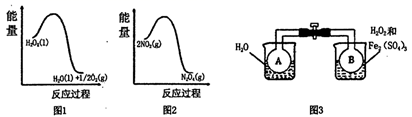
-
(3) 该小组预测同为第四周期VIII族的Fe、Co、Ni可能有相似的催化作用。查阅资料:CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知法制取得到的催化剂活性更高,推测Co2+、Ni2+两种离子中催化效果更好的是。

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断,下列说法正确的是( )
-
(1) I.甲醇裂解制氢法
该方法的主反应:

 ,此反应能自发进行的原因是。
,此反应能自发进行的原因是。 -
(2) 一定温度下,向某一刚性恒容密闭容器中充入
 ,发生反应
,发生反应  ,反应起始时
,反应起始时  的压强为5.00MPa,th后反应达到平衡,此时
的压强为5.00MPa,th后反应达到平衡,此时  的物质的量分数为60%,此时平衡常数
的物质的量分数为60%,此时平衡常数  (
(  为以平衡分压表示的平衡常数)。
为以平衡分压表示的平衡常数)。
-
(3) II.甲醇水蒸气重整制氢法在某催化剂的作用下,该方法的部分反应如下:
主反应:
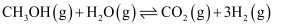
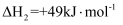
副反应:
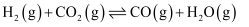
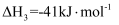
在相同时间内,不同温度下测得
 的转化率、CO的生成率与温度的变化关系如图所示。
的转化率、CO的生成率与温度的变化关系如图所示。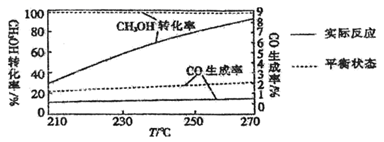
升高温度,甲醇的实际转化率越来越接近平衡转化率的原因是。
-
(4) 从图像中发现,无论是主反应还是副反应,升温对其平衡的影响都非常小,原因是。
-
(5) 在另外一种催化剂下,甲醇与水发生两个反应
主反应:
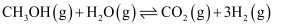 活化能
活化能 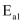
副反应:
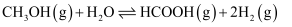 活化能
活化能 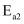
研究发现,在催化剂活性温度区间,升温有利于提高主反应的选择性,则
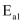
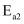 (>、=、<)
(>、=、<)
![]() (g)
(g) 
![]() (g)+H2(g)
(g)+H2(g) 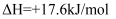
-
(1) 该反应在条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施是。
-
(2) 当原料气中乙苯和水蒸气的物质的量之分别为1mol和4mol,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。已知:A物质的分压为P(A)=
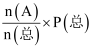 。则平衡时水的分压P(H2O)=kPa
。则平衡时水的分压P(H2O)=kPa 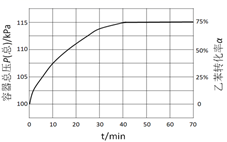
-
(3) 在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图见下。若其它条件不变,amol乙苯在
 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。
L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。 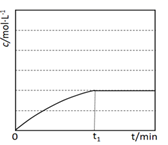
 ),医学上广泛应用于缓解咳嗽症状。用有机物甲合成沐舒坦的路线如下(部分步骤已省略)
),医学上广泛应用于缓解咳嗽症状。用有机物甲合成沐舒坦的路线如下(部分步骤已省略)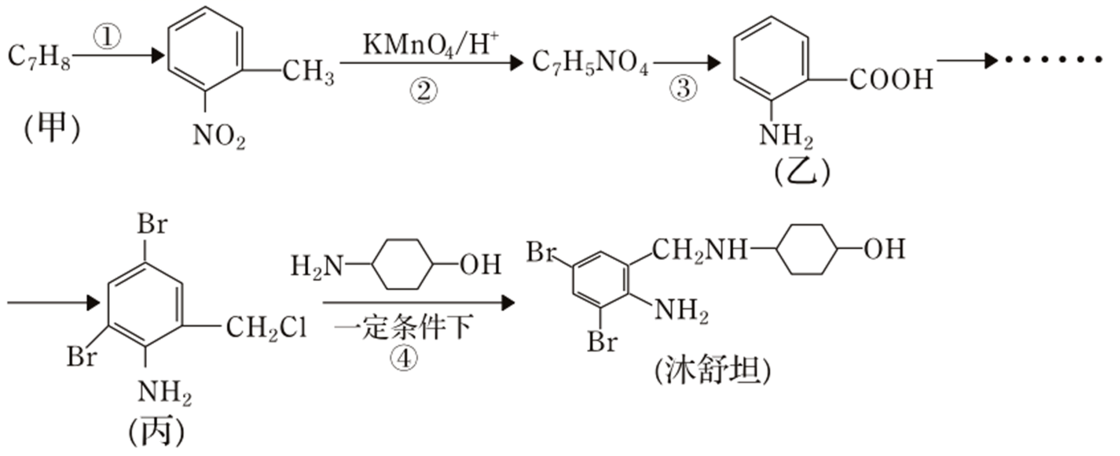
已知:①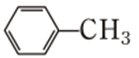

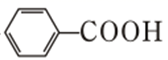
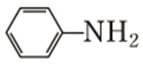
②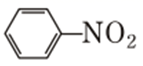

-
(1) 反应①的反应类型是。
-
(2) 化合物丙的分子式为。
-
(3) 写出反应④的化学反应方程式(已知反应④为可逆反应,条件不用写出) 。反应④进行过程中加入
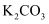 会显著提升沐舒坦产率,其原因是。
会显著提升沐舒坦产率,其原因是。
-
(4) 请写出符合下列要求的化合物乙的一种同分异构体的结构简式。
①苯环上两个取代基;②核磁共振氢谱中的峰面积之比为3∶2∶2;
-
(5) 根据题目信息和已知知识,写出以对二甲苯为原料制取的流程
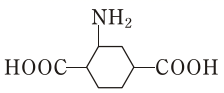 的流程示意图(无机试剂任选) 。
的流程示意图(无机试剂任选) 。

-
(1) 煤的气化发生的主要反应是:
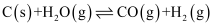 。
。已知:
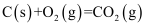
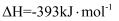

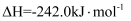


煤气化时发生主要反应的热化学方程式是。
-
(2) 用煤气化后得到的
 合成氨:
合成氨: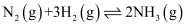
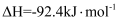 。在容积为2L的密闭容器中投入
。在容积为2L的密闭容器中投入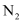 和
和 充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是(填字母)。
充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是(填字母)。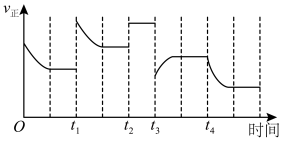
a.t1时可能增大了
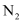 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气c.t3时可能降低了温度 d.t4时可能分离出氨气
-
(3) 如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1L2 (填“>”或“<”),理由是。
的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1L2 (填“>”或“<”),理由是。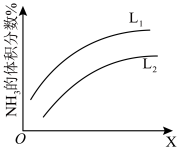
-
(4) 某温度时合成甲醇的反应

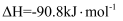 , 在容积固定的密闭容器中,各物质的浓度如下表所示:
, 在容积固定的密闭容器中,各物质的浓度如下表所示:浓度
时间
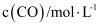
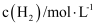
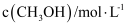
0
1.0
1.8
0
2min
0.5
0.5
4min
0.4
0.6
0.6
6min
0.4
0.6
0.6
①前2min的反应速率
 。
。②该温度下的平衡常数。(可用分数表示)
-
(1) 结合钠与水的反应观象,从能量变化的角度看,钠与水的反应属于反应。
-
(2) 以硫酸铜为电解质溶液的银锌原电池中。银片上观察到的现象是;锌电极的反应式为,溶液中
 向极移动。
向极移动。
-
(3) 将一定量的A气体和B气体在2L的密闭容器中混合并在一定条件下发生反应;
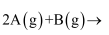
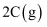 , 反应2min后测得C的浓度为0.6mol/L。
, 反应2min后测得C的浓度为0.6mol/L。①用物质B表示的平均反应速率为
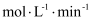 。
。②其他条件不变时,再通入2molA气体,该反应的正反应速率将(填“增大”“不变”或“减小”)。
 、
、 、
、 、
、 等)的治理,成为化学研究的热点问题。
等)的治理,成为化学研究的热点问题。
-
(1) 已知
 与
与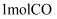 在催化剂
在催化剂 表面转化为无害气体能量变化过程如图所示,
表面转化为无害气体能量变化过程如图所示,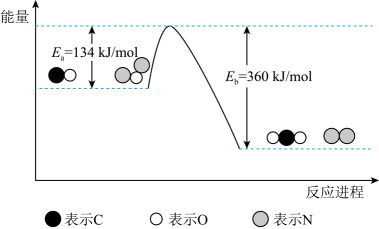
该反应的热化学方程式为,该反应分两步进行:第一步:
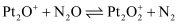 , 第二步反应式为。
, 第二步反应式为。 -
(2) 在恒温恒容密闭容器中进行:
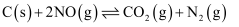
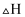
①下列说法能说明上述反应一定达平衡状态的是。
A.容器内混合气体的压强保持不变
B.容器内混合气体的平均相对分子质量保持不变
C.
 的状态
的状态D.容器内
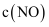 与
与 的比值保持不变
的比值保持不变②一定温度下,将一定量的活性炭和
 加入容器中发生上述反应,反应进行到
加入容器中发生上述反应,反应进行到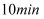 达平衡,此时
达平衡,此时 的体积分数为30%,该反应的平衡常数K=,若
的体积分数为30%,该反应的平衡常数K=,若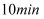 后升高温度,达到新平衡时,容器中
后升高温度,达到新平衡时,容器中 、
、 、
、 的浓度之比为
的浓度之比为 , 则△H0(填“>”或“<”),其理由。
, 则△H0(填“>”或“<”),其理由。 -
(3) 利用如图所示装置(电极均为石墨电极)可同时吸收工业尾气
 和
和 。
。
①若乙为甲烷燃料电池,则A电极上的反应式为。
②透过交换膜的离子是,C电极上的反应式为。



