第二节 影响化学反应速率的因素 知识点题库
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)⇌C6H5CH=CH2(g)+H2(g)△H

-
(1) 已知:H2和CO的燃烧热(△H)分别为﹣285.8kJ.mol•L﹣1和﹣283.0kJ.mol•L﹣1;
C6H5CH2CH3(g)+CO2(g)⇌C6H5CH=CH2(g)+CO(g)+H2O(I)△H=+114.8kJ•mol﹣1
则制取苯乙烯反应的△H为
-
(2) 向密闭容器中加入1mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ.下列说法正确的是 .A . 升高温度,正反应速率减小,逆反应速率增大 B . 若继续加入1mol乙苯,苯乙烯转化率增大 C . 压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 D . 相同条件下若起始加入1mol苯乙烯和1mol氢气,达平衡时反应能量变化为(△H﹣Q)kJ
-
(3) 向2L密闭容器中加入1mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示.700℃时,乙苯的平衡转化率为,此温度下该反应的平衡常数为;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是.
-
(4) 含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2 , 该阳极的电极反应式为,若去除0.5mol苯乙烯,两极共收集气体mol.
反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A . v(D)=0.40 mol•L﹣1•s﹣1
B . v(C)=0.50 mol•L﹣1•s﹣1
C . v(B)=1.2 mol•L﹣1•min﹣1
D . v(A)=0.30 mol•L﹣1•s﹣1
合成氨反应:N2(g)+3H2(g)⇌2ΝΗ3(g)△H=﹣92.4kJ•mol﹣1 , 在反应过程中,正反应速率的变化如图:

下列说法可能正确的是( )
A . t1时增大了压强
B . t2时增大了压强
C . t3时降低了温度
D . t4时降低了温度
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
A . 加入少量水,产生H2速率减小,H2体积不变
B . 加入NH4HSO4固体,产生H2速率不变,H2体积不变
C . 加入CH3COONa固体,产生H2速率减小,H2体积减小
D . 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变
某温度下,反应H2(g)+I2(g)  2HI(g)在密闭容器中达到平衡,缩小容器体积,增大压强,则下列说法正确的是( )
2HI(g)在密闭容器中达到平衡,缩小容器体积,增大压强,则下列说法正确的是( )
A . 平衡正向移动
B . 正反应速率增大
C . 容器内I2(g)增多
D . 容器内H2的质量分数增大
在恒温2 L密闭容器中通入气体X并发生反应:2X(g)  Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
 Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是( )
A . 虚线表示使用催化剂的情形
B . b、c两点表明反应在相应条件下达到了最大限度
C . 反应进行到a点时放出的热量大于反应进行到b点时放出的热量
D . 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L·min)
工业上制硫酸的一步重要的反应是SO2在400-500℃下催化氧化反应: 2SO2+O2  2SO3 , 该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2SO3 , 该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
 2SO3 , 该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2SO3 , 该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
A . 使用催化剂的目的是加快反应速率,提高生产效率
B . 在上述条件下,SO2不可能100%地转化为SO3
C . 增加O2的浓度,可以提高SO2的转化率
D . 当SO2和SO3的浓度相等时,反应一定达到平衡
某化学反应2A  B+C(吸热反应)分别在以下三种不同条件下进行,
B+C(吸热反应)分别在以下三种不同条件下进行,
B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。

根据上述数据,回答下列问题:
 B+C(吸热反应)分别在以下三种不同条件下进行,
B+C(吸热反应)分别在以下三种不同条件下进行,B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。

根据上述数据,回答下列问题:
-
(1) 在实验1、2中,实验2可能使用了,判断理由是。
-
(2) 在实验1、3中,实验3比实验1达到平衡的时间较短,原因是。
-
(3) 在实验2、3中,化学反应达到平衡时,实验3中c(A)较小的原因是。
-
(4) 在实验2中,10~20min的平均反应速率v(B)=mol·L-1·min-1。实验3达到平衡时,A的转化率为。
相同条件下,下列关于反应速率的判断正确的是( )
A . 0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2mol·L-1的NaOH溶液反应的速率相同
B . 0.1 mol·L-1的盐酸和0.1 mol·L-1的硝酸分别与大小相同的大理石反应的速率相同
C . Mg和Fe分别与0.1 mol·L-1的盐酸反应的速率相同
D . 大理石块与大理石粉分别与0.1 mol·L-1的盐酸反应的速率相同
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A . 10℃ 20 mL 3 mol·L-1的X溶液
B . 20℃ 30 mL 2 mol·L-1的X溶液
C . 20℃ 10 mL 4 mol·L-1的X溶液
D . 10℃ 10 mL 2 mol·L-1的X溶液
下列图示与对应的叙述一定正确的是( )
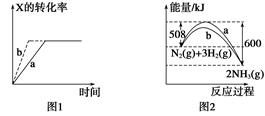
A . 图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大
B . 图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
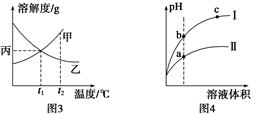
C . 图3所示,t1 ℃时质量分数均为20%的甲、乙两种溶液,升温到t2 ℃时,两种溶液中溶质的质量分数仍然相等
D . 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
3Z(g),b的压强一定比a大
B . 图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C . 图3所示,t1 ℃时质量分数均为20%的甲、乙两种溶液,升温到t2 ℃时,两种溶液中溶质的质量分数仍然相等
D . 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
 3Z(g),b的压强一定比a大
B . 图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C . 图3所示,t1 ℃时质量分数均为20%的甲、乙两种溶液,升温到t2 ℃时,两种溶液中溶质的质量分数仍然相等
D . 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
3Z(g),b的压强一定比a大
B . 图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C . 图3所示,t1 ℃时质量分数均为20%的甲、乙两种溶液,升温到t2 ℃时,两种溶液中溶质的质量分数仍然相等
D . 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
下列反应中产生气泡最快的是 ( )
| 温度 | 浓度 | 催化剂 | |
| A | 25 ℃ | 2 mL 5% H2O2 | 0.1 mol·L-1 FeCl3 2滴 |
| B | 35 ℃ | 2 mL 8% H2O2 | MnO2粉末 |
| C | 25 ℃ | 2 mL 5% H2O2 | MnO2粉末 |
| D | 25 ℃ | 2 mL 8% H2O2 | 无 |
A . A
B . B
C . C
D . D
在密闭容器中发生反应2SO2(g)+O2(g) ⇌2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析正确的是( )

A . 图I研究的是t1时刻升高温度对反应速率的影响
B . 图I研究的是加入合适催化剂对反应速率的影响
C . 图II研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
D . 图III研究的是温度对化学平衡的影响,且乙的温度较高
一定温度下,100mL2mol·L-1硫酸溶液和过量的锌粉反应,为了减慢该反应速率,但又不影响生成氢气的总量。可向反应体系中加入适量的( )
A . CH3COOK溶液
B . 稀盐酸
C . 2mol·L-1的硫酸溶液
D . ZnSO4固体
设C(s)+CO2(g)  2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)  2NH3(g);ΔH2<0反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况为( )
2NH3(g);ΔH2<0反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况为( )
 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)  2NH3(g);ΔH2<0反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况为( )
2NH3(g);ΔH2<0反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况为( )
A . 同时增大
B . 同时减小
C . v1增大,v2减小
D . v1减小,v2增大
CO2 + 4H2  CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是( )
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是( )
 CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是( )
CH4 + 2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是( )
A . 适当升温能加快反应速率
B . 催化剂对反应速率无影响
C . 达到平衡时,正反应速率为0
D . 达到平衡时,CO2能100%转化为CH4
少量铁片与100mL0.1mol·L-1的稀盐酸反应(盐酸过量),为了加快此反应速率而不改变产生H2的量,如下方法可行的是( )
A . 加入少量铁粉
B . 通入少量的HCl气体
C . 加入50mlNaCl溶液
D . 滴入几滴硫酸铜溶液
石墨烯是一种新型二维平面纳米材料,在纳米电子器件、能量存储及复合材料等领域均具有广阔的应用前景。石墨烯可以由氧化石墨烯与肼( 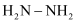 )或硼氢化钠(
)或硼氢化钠(  )反应制得。
)反应制得。
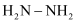 )或硼氢化钠(
)或硼氢化钠(  )反应制得。
)反应制得。
-
(1) 下图是氧化石墨烯的结构模型,含氧官能团有醚键、羟基和,由氧化石墨烯转化为石墨烯所发生的有机反应,称为反应。

-
(2) 肼的电子式为,硼氢化钠的结构式为
-
(3) 与肼的反应过程如下图:

①反应过程中持续搅拌1小时,且需要冷凝回流,原因是。
②石墨烯饱和的水分散系导电性(填“大于”、“等于”或“小于”)石墨烯饱和的有机小分子分散系。
室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法不正确的是( )

A . 0~30min内,Y的平均反应速率为2.5×10-3mol·L-1·min-1
B . 反应开始后,体系中Y和Z的浓度之比保持不变
C . 升高相同温度对反应①速率变化的影响更大
D . 由于60min时c(Z)具体数值未知,故无法求反应②在0-60min的化学反应速率
已知反应
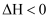 , 下列说法正确的是( )
, 下列说法正确的是( )

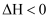 , 下列说法正确的是( )
, 下列说法正确的是( )
A . 该反应的能量变化如如图所示
B . 理论上该反应可以设计成原电池
C . 升高温度,该反应的化学反应速率不一定加快
D . 1 mol  和1 mol
和1 mol 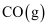 的总能量低于1 mol
的总能量低于1 mol  和1 mol
和1 mol  的总能量
的总能量
 和1 mol
和1 mol 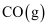 的总能量低于1 mol
的总能量低于1 mol  和1 mol
和1 mol  的总能量
的总能量
最近更新



