第二节 影响化学反应速率的因素 知识点题库
回答下列问题:
-
(1) 滴定时,应使用(填“酸式”或“碱式”) 滴定管,原因是。
-
(2) 水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是。
-
(3) 滴定达到终点的标志是。
-
(4) 实验过程中测得数据如下表:
编号
1
2
3
V(水样)/mL
10.00
10.00
10.00
c(AgNO3)/ mol·L-1
0.0010
V(AgNO3)/mL
3.75
4.01
3.99
计算水样中氯离子的含量为mg/L(保留2位小数)
-
(5) 滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=。
②已知2AgCl+ CrO42-
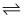 2Cl-+Ag2CrO4 , 计算出该反应的平衡常数为。
2Cl-+Ag2CrO4 , 计算出该反应的平衡常数为。 -
(6) 下列情况会造成实验测定结果偏低的是____________。(填标号)A . 锥形瓶洗涤后未干燥 B . 滴定前,未使用标准液润洗滴定管 C . 酸式滴定管滴定前仰视读数,滴定后俯视读数 D . 酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
①加H2O ②加NaOH固体 ③将盐酸用量减半,浓度不变 ④加CuO固体 ⑤加NaCl溶液 ⑥加入硝酸钾溶液 ⑦降低温度(不考虑盐酸挥发)
-
(1) NaClO2的化学名称为。
-
(2) 在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
离子
SO42-
SO32-
NO3-
NO2-
Cl-
c/(mol/L)
8.35×10-4
6.87×10-6
1.5×10-4
1.2×10-5
3.4×10-3
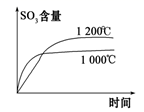
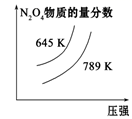
①出NaClO2溶液脱硝过程中主要反应的离子方程式。增加压强,NO的转化率(填“提高”“不变”或“降低”)。
②着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是。
-
(3) 如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是。
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=。

| A | B | C | D |
| | | | |
| 2SO2(g)+O2(g)⇌2SO3(g) ∆H=-akJ/mol | N2(g)+3H2(g) ⇌2NH3(g) ∆H=-bkJ/mol | N2O4(g)⇌2NO2(g) ∆H=+ckJ/mol | CO2(g)+C(s) ⇌2CO(g) ∆H=+dkJ/mol |
-
(1) I.用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
实验过程如上图所示,分析判断段化学反应速率最快(填OE、EF或FG)。
-
(2) 将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是。
-
(3) 为了减缓上述反应的速率,欲向溶液中加入下列物质少许,你认为可行的是_____。A . 硫酸铜溶液 B . 水 C . 浓盐酸
-
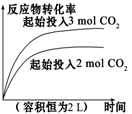
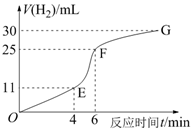
(4) Ⅱ.某温度时,在2 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:
该反应的化学方程式:;
-
(5) 反应开始至2 min末,X的反应速率为(mol·L﹣1·min﹣1);
-
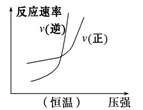
(6) 反应前的压强与平衡时的压强之比为。
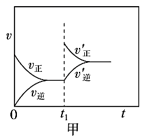 B . 图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小
B . 图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小 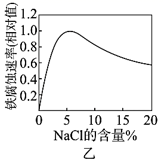 C . 图丙说明石墨转化为金刚石的反应的△H>0
C . 图丙说明石墨转化为金刚石的反应的△H>0 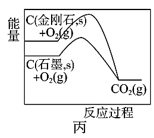 D . 图丁是一定条件下发生反应:4NH3+4NO+O2⇌4N2+6H2O,此过程△H<0
D . 图丁是一定条件下发生反应:4NH3+4NO+O2⇌4N2+6H2O,此过程△H<0 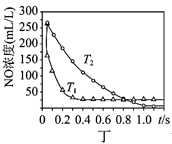
-
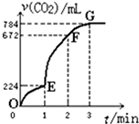
(1) 下列分析不正确的是________。A . OE段表示的平均速率最快 B . EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)· C . EF段表示的平均速率最快,主要原因是反应放热 D . G点表示收集的CO2的量最多
-
(2) 为了降低上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是________。A . 蒸馏水 B . NaCl固体 C . CH3COONa固体 D . 浓盐酸
-
(3) 除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(填一种方法即可)。
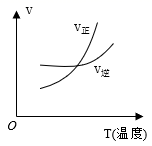 B .
B . 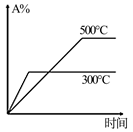 C .
C .  D .
D . 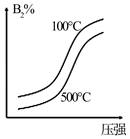

已知:
I.pH=-lgc(H+);
II.酸性条件下MnO2被还原为Mn2+。
下列说法错误的是( )
 +3H2O=2Fe(OH)3↓+3CO2↑
D . 若用氨水调节溶液pH也可以使Fe3+转化为沉淀
+3H2O=2Fe(OH)3↓+3CO2↑
D . 若用氨水调节溶液pH也可以使Fe3+转化为沉淀
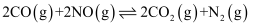 , 该反应为放热反应。下列有关叙述正确的是( )
, 该反应为放热反应。下列有关叙述正确的是( )
①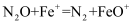 (慢)
(慢)
②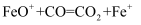 (快)
(快)
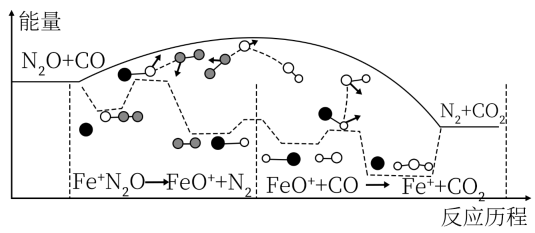
下列叙述错误的是( )