第二节 水的电离和溶液的酸碱性 知识点题库
水的电离平衡曲线如图所示,下列说法正确的是( )
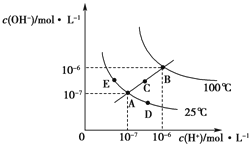
A . 图中五点KW间的关系:B=C=A=D=E
B . 若从A点到D点,可采用:温度不变在水中加入少量的酸
C . 若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D . 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性
有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.
求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=和c(NaOH)=.
在t℃时,某NaOH稀溶液中,c(H+)=10﹣a mol/L,c(OH﹣)=10﹣b mol/L,已知a+b=13,则在该温度下,将100mL 0.10mol/L的稀硫酸与100mL 0.40mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A . 11.52
B . 11.70
C . 11.82
D . 12.00
下列溶液:①pH=0的盐酸,②0.5mol•L﹣1的盐酸溶液,③0.1mol•L﹣1的氯化钠溶液,④0.1mol•L﹣1的氢氧化钠溶液,⑤0.1mol•L﹣1的氢氧化钡溶液;由水电离的H+浓度由大到小的顺序正确的是( )
A . ①②③④⑤
B . ③④⑤②①
C . ①②③⑤④
D . ⑤③④①②
25℃时,若10mL pH=a的盐酸与100mL pH=b的Ba(OH)2溶液恰好完全反应,则a+b的值为( )
A . 14
B . 15
C . 13
D . 无法确定
下列说法正确的是( )
A . 可用碱式滴定管量取12.85 mL的KMnO4溶液
B . 测定氯水的pH,用干燥洁净的玻璃棒蘸取该溶液滴在湿润的pH试纸上
C . 反应物的总能量低于生成物的总能量时,一定不能自发进行反应
D . 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定
表是不同温度下水的离子积常数:
温度/℃ | 25 | T2 |
水的离子积常数 | 1×10﹣14 | 1×10﹣12 |
试回答以下问题:
T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= .此溶液中各种离子的浓度由大到小的顺序是 .
常温下,向20mL0.1mol/L氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如右图所示。下列说法错误的是( )

A . 常温下,0.1mol/L氨水的电离平衡常数Kb约为1.0×10-5
B . a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C . c点溶液中c(NH4+)<c(Cl-)
D . c点溶质为NH4Cl、HCl
25℃时,水的电离达到平衡: H2O  H++ OH-ΔH > 0 ,下列叙述正确的是( )
H++ OH-ΔH > 0 ,下列叙述正确的是( )
 H++ OH-ΔH > 0 ,下列叙述正确的是( )
H++ OH-ΔH > 0 ,下列叙述正确的是( )
A . 将水加热,Kw增大,pH不变
B . 向水中加入少量盐酸,c(H+)增大,Kw不变
C . 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D . 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
下列说法或表述正确的是( )
A . 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH = 7
B . 某醋酸稀溶液的pH = a,将此溶液稀释一倍后,溶液的pH = b,则a > b
C . Ba(OH)2溶液中加入过量Al2(SO4)3溶液,反应的离子方程式为:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓ + 2Al(OH)3↓
D . 物质的量浓度均为1 mol·L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值)
已知某温度下,0.1mol/LNaHA的强电解质溶液中,c(H+)<c(OH-),则下列关系或说法一定错误的是( )
A . c(Na+)=c(HA-)+2c(A2-)+c(OH-)
B . c(H2A)+c(HA-)+c(A2-)=0.1mol/L
C . 无法确定水的离子积常数
D . c(A2-)+c(OH-)=c(H+)+c(H2A)
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A . 在NaClO和NaCl的混合溶液中:Ag+、K+、NO3-、I-
B .  =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C . K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D . 由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C . K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D . 由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
 =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C . K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D . 由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C . K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D . 由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
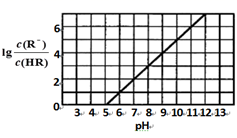
A . 0.1mol·L-1HR溶液的pH为5
B . HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C . 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D . 当c(R-)= c(HR)时,溶液必为中性
下列实验操作,对实验结果不会产生影响的是( )
A . 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗
B . 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次
C . 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中
D . 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH
NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
-
(1) 常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=mol·L-1(填数值)。
-
(2) 80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是 (用离子方程式并结合文字叙述回答)。
-
(3) 常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为。
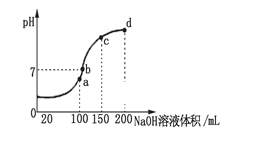
-
(4) 常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19。常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
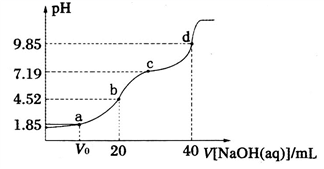
A . a点所得溶液中:V0=10 mL
B . b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C . c点所得溶液中:c(A2-)=c(HA-)
D . d点所得溶液中A2-水解平衡常数Khl=10-7.19
下列说法中正确的是( )
A . AgCl悬浊液中存在平衡:AgCl(s)  Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小( )
B . AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
C . 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
D . 硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42- , 加热煮沸可完全除去其中的Ca2+、Mg2+
Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小( )
B . AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
C . 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
D . 硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42- , 加热煮沸可完全除去其中的Ca2+、Mg2+
 Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小( )
B . AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
C . 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
D . 硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42- , 加热煮沸可完全除去其中的Ca2+、Mg2+
Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小( )
B . AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
C . 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
D . 硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42- , 加热煮沸可完全除去其中的Ca2+、Mg2+
25℃时,向10 mL 0.1 mol/LNaOH溶液中,逐滴加入10 mL浓度为c mol/L的HF稀溶液。已知 25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ/mol ②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。请根据信息判断,下列说法中错误的是( )
A . 整个滴加过程中,水的电离程度不一定存在先增大后减小的变化趋势
B . 将氢氟酸溶液温度由25℃升高到35℃时,HF的电离程度减小(不考虑挥发)
C . 当c>0.1时,溶液中才有可能存在c(Na+)=c(F-)
D . 若滴定过程中存在:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1
下列有关仪器的使用方法或实验操作正确的是( )
A . 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B . 用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体
C . 测定新制氯水的pH,用玻璃棒取液体滴在pH试纸上,再对照标准比色卡读数
D . 酸碱中和滴定时,滴定管使用前需用待装液润洗而锥形瓶不用
MOH是一种一元弱碱,25℃时, 在20.0mL 0.1 mol·L-1MOH溶液中滴加0.1 mol·L-1盐酸V mL, 混合溶液的pH与 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )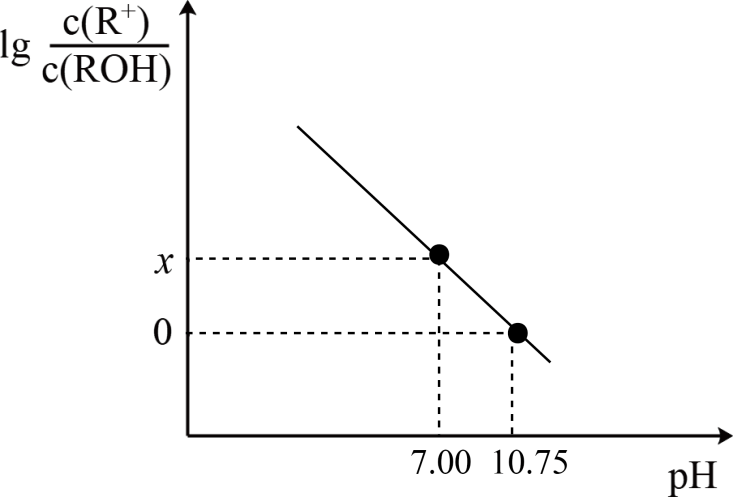
A . x=3.75
B . a点时,V=10.0 mL
C . 25℃时, MOH的电离常数Kb的数量级为10-4
D . V=20.0 mL时,溶液存在关系: 2c(H+) + c(M+) = c(MOH) +2c(OH-)+ c(Cl-)
最近更新



