第四节 难溶电解质的溶解平衡 知识点题库
相关化合物 | AgX | AgY | Ag2Z |
pKsp | a | b | c |

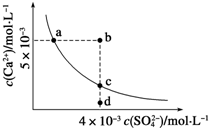
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为: .
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp= .
(3)往1.00L 1.00mol•L﹣1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol.
-
(1) NH4Cl溶液显性,原因是(用离子方程式表示),若加入少量的氨水,使溶液中c(NH4+)=c(Cl﹣),则溶液的pH7 (填“>”、“<”或“=”).
-
(2) 氨水显碱性的原因(用离子方程式表示),向氨水中加入NH4Cl固体,氨水的电离程度(填“增大”、“减小”或“不变”),溶液的pH将(填“增大”、“减小”或“不变”).
-
(3) Mg(OH)2浊液中存在Mg(OH)2的溶解平衡,可表示为(用离子方程式表示),向此浊液中加入浓的NH4Cl溶液,观察到的现象是.
-
(4) 用离子方程式解释下列事实
①盛NaF溶液要用塑料瓶而不能用玻璃瓶
②盛纯碱溶液的试剂瓶用橡胶塞而不能用玻璃塞.

海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl﹣ | HCO3 |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10﹣5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10﹣9;Ksp(MgCO3)=6.82×10﹣6;
Ksp[Ca(OH)2]=4.68×10﹣6;Ksp[Mg(OH)2]=5.61×10﹣12 .
下列说法正确的是( )
-
(1) 处理废水时常需加入混凝剂,如明矾、PAN 等。
①写出明矾中Al3+水解的离子方程式。
②PAN化学式为
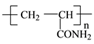 ,其单体的结构简式为。
,其单体的结构简式为。 -
(2) 处理高浓度的含酚废水的方法之一是萃取回收法,其流程如下:
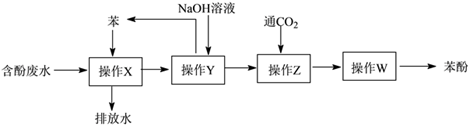
①该流程中涉及分液操作次(填数字)。
②“操作Z”中发生反应的化学方程式为。
-
(3) 用FeS除去废水中汞盐的反应为Hg2++FeS
 HgS + Fe2+ , 该反应的平衡常数为K= [填数值,已知:Ksp(FeS)=6.4×10-15 , Ksp(HgS)=1.6×10-52]。
HgS + Fe2+ , 该反应的平衡常数为K= [填数值,已知:Ksp(FeS)=6.4×10-15 , Ksp(HgS)=1.6×10-52]。
-
(4) 处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10 , 沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是。
②惰性电极电解时,CN-在阳极最终氧化为CO
 、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为(不考虑副反应)。
、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为(不考虑副反应)。③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为。
-
(5) 纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为。

-
(1) Mn3O4中的Mn元素有+2价和+3价两种情况,则 Mn3O4中+2价与+3价Mn 元素的物质的量之比为。
-
(2) “反应I”(填“是”或“不是”)氧化还原反应,为提高反应的反应速率,可采取的措施有(答出一条即可)。
-
(3) “反应II”的反应原理是。
-
(4) 试剂a的电子式为。
-
(5) “一系列操作”指,该过程用到的非玻璃仪器为。
-
(6) 流程图中“煅烧”操作的温度与剩余固体质量变化曲线如图所示。
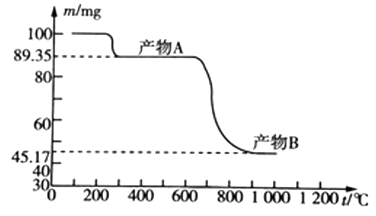
则产物A的化学式为,产物B的化学式为。
-
(1) 铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
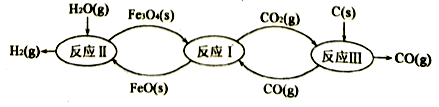
已知:i. Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1ii. 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1iii. C(s)+CO2(g)
 2CO(g);△H3=+172.4 k]·mol-1
2CO(g);△H3=+172.4 k]·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是。
-
(2) T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s)
 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是(填写字母)。
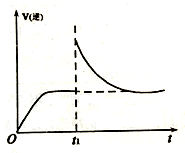
a.保持温度不变,压缩容器
b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉
d.保持体积不变,增大CO浓度
-
(3) 在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示
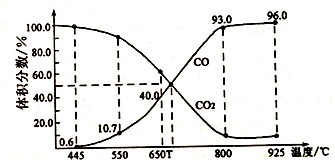
①650℃时,该反应达平衡后吸收的热量是。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡(填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
-
(4) 用原电池原理可以除去酸性废水中的三氯乙烯、AsO3- , 其原理如下图所示(导电壳内部为纳米零价铁)
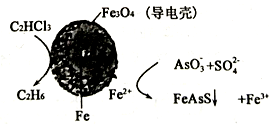
在除污过程中,纳米零价铁中的Fe为原电池的极(填“正”或“负”),写出C2HCl3在其表面转化为乙烷的电极反应式为。
-
(5) 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38 , 此温度下若在实验室中配制100mL5mol·L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol·L-1的盐酸mL(忽略加入盐酸体积)。
| 选项 | 结论 | 操作 |
| A | CO32-水解是吸热反应 | 在0.1 mol/LNa2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 |
| B | Ksp(BaSO4)>Ksp(BaCO3) | 常温下,用饱和Na2CO3溶液可将BaSO4全部转化为BaCO3 |
| C | 酸性A比B强 | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 |
| D | 金属性:M>N | 由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
-
(1) 在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s)
 CO2(g)+CO(g)+H2O(g),下列全叙述能说明反应已经达到平衡状态的是 。
A . 压强不再变化 B . CO2(g)的体积分数保持不变 C . 混合气体的密度不再变化 D . 混合气体的平均
CO2(g)+CO(g)+H2O(g),下列全叙述能说明反应已经达到平衡状态的是 。
A . 压强不再变化 B . CO2(g)的体积分数保持不变 C . 混合气体的密度不再变化 D . 混合气体的平均 -
(2) 工业上可以通过CO(g)+2H2(g)
 CH3OH(g)制造甲醇在一容积可变容器中充入2molCO和4molH2 , CO的平衡转化率随温度(T)、压强(P)的变化关系如图所示,该反应的△H0(填“>”、“<”或”=”) ,比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小V正(CO)V逆(CH3OH)(填”>”、”<”或“=”)。
CH3OH(g)制造甲醇在一容积可变容器中充入2molCO和4molH2 , CO的平衡转化率随温度(T)、压强(P)的变化关系如图所示,该反应的△H0(填“>”、“<”或”=”) ,比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小V正(CO)V逆(CH3OH)(填”>”、”<”或“=”)。 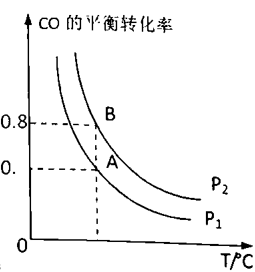
若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。
-
(3) 从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是。
-
(4) 常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)
-
(5) 有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe,则放电时负极反应式为。该电池充电时,当转移2mol电子时,阳极质量的变化量为g。

 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
| C | 向5 mL 0.1 mol·L-1KI溶液中加入0.1 mol·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
| D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
 、
、  或Ca2+)与pH的关系如图所示。下列说法正确的是( )
或Ca2+)与pH的关系如图所示。下列说法正确的是( ) 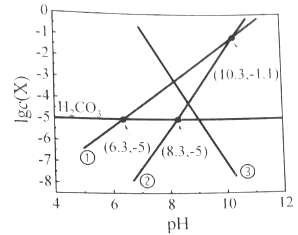
 B . H2CO3的一级电离常数为10-8.3
C . c(Ca2+)随 pH升高而增大
D . pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-1
B . H2CO3的一级电离常数为10-8.3
C . c(Ca2+)随 pH升高而增大
D . pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-1
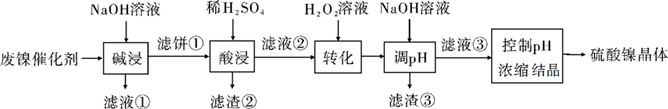
 是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: 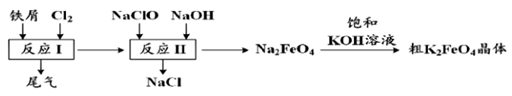
下列叙述错误的是( )
 作水处理剂时,既能杀菌消毒又能净化水
B . 反应Ⅰ中尾气可用
作水处理剂时,既能杀菌消毒又能净化水
B . 反应Ⅰ中尾气可用  溶液吸收再利用
C . 反应Ⅱ中氧化剂与还原剂的物质的量之比为
溶液吸收再利用
C . 反应Ⅱ中氧化剂与还原剂的物质的量之比为 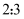 D . 该条件下,物质的溶解性:
D . 该条件下,物质的溶解性: 
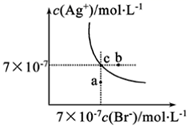
 AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol·L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
-
(1) “碱浸”中NaOH的两个作用分别是;写出NaOH与Al2O3反应的离子方程式。
-
(2) “滤液②”中含有的金属离子是。
-
(3) “转化”中可替代H2O2的物质是。若工艺流程改为先“调pH”后 “转化”,即
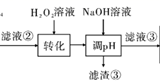 ,“滤液③”中可能含有的杂质离子为。
,“滤液③”中可能含有的杂质离子为。
-
(4) 利用上述表格数据,计算Ni(OH)2的Ksp=。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1 , 则“调pH”应控制的pH范围是。
-
(5) 硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式。
 )可吸收烟气中的
)可吸收烟气中的  ,同时可制备
,同时可制备  ,工艺流程如下:
,工艺流程如下: 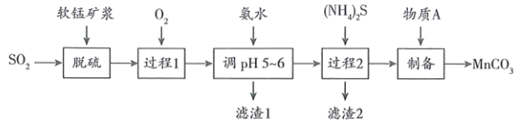
资料:①吸收  后的软锰矿浆中含有
后的软锰矿浆中含有  、
、  、
、  、
、  等阳离子;
等阳离子;
②金属离子沉淀的pH如下表。
| 金属离子 | | | | | |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 8.2 |
-
(1) 脱硫的产物是
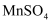 ,软锰矿中
,软锰矿中  所起的作用是。
所起的作用是。
-
(2) 过程1向浆液中通入
 的目的是。
的目的是。
-
(3) 滤渣1的成分是,过程2中发生反应的离子方程式为。
-
(4) 制备
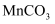 的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是。
的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是。
-
(5) 已知:常温下,
 溶液的pH约为9.3,
溶液的pH约为9.3, 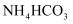 溶液的pH约为7.8.请推测物质A,并写出制备
溶液的pH约为7.8.请推测物质A,并写出制备 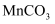 时发生反应的离子方程式:。
时发生反应的离子方程式:。
-
(6) 取m g碳酸锰样品,加适量硫酸加热溶解后,用
 的
的  溶液滴定,至滴定终点时,消耗
溶液滴定,至滴定终点时,消耗  溶液的体积为
溶液的体积为 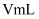 。(已知:反应产物为
。(已知:反应产物为  ,杂质不参与反应),样品中
,杂质不参与反应),样品中 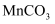 质量分数的计算式为(用质量分数表示)。
质量分数的计算式为(用质量分数表示)。
①向2mL 0.1mol/L FeCl3溶液中加入过量Cu粉,充分反应后,溶液变蓝。2天后,溶液变为浅蓝色,有白色不溶物生成。
②取①中浅蓝色的上层清液,滴加KSCN溶液,溶液变红,出现白色浑浊。振荡后白色浑浊物增多,红色褪去。经检验,白色不溶物是CuSCN。
③向2mL 0.1mol/LCuSO4溶液中滴加KSCN溶液,未观察到白色浑浊。放置24小时后,出现白色不溶物。
已知:CuCl和CuSCN均为白色不溶固体
下列说法不正确的是( )




