第四节 难溶电解质的溶解平衡 知识点题库
操作及现象 | 结论 | |
A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
 .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
-
(1) 写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:
②SO2与Ca(OH)2悬浊液反应:
-
(2) 试说明用熟石灰的悬浊液而不用澄清石灰水的理由.
-
(3) 在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在二十世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,地表面SO2浓度却降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?简述理由,危害.
 的比值为( )
的比值为( ) 
 B .
B .  C .
C .  D .
D . 

-
(1) T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(
 )=10-3 mol·L-1 , 则Ca2+是否沉淀完全?(填“是”或“否”)。
)=10-3 mol·L-1 , 则Ca2+是否沉淀完全?(填“是”或“否”)。 [已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
-
(2) 已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH
<8.0
8.0~9.6
>9.6
颜色
黄色
绿色
蓝色
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为。
-
(3) 向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10 , 忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=。
②完全沉淀后,溶液的pH=。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?(填“是”或“否”)。
 体系中,
体系中,  和
和  的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
 三点对应的
三点对应的  相等
B .
相等
B . 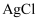 在c点的溶解度比b点的大
C .
在c点的溶解度比b点的大
C . 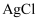 溶于水形成的饱和溶液中,
溶于水形成的饱和溶液中,  D . b点的溶液中加入
D . b点的溶液中加入 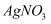 ,固体,
,固体,  沿曲线向c点方向变化
沿曲线向c点方向变化
-
(1) 写出酸H2A的电离方程式:
-
(2) 若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为mol.L-1。
-
(3) 若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为(填序号,下同);pH由大到小的顺序为

| 实验目的 | 实验方案 | |
| A | 验证H2O2具有氧化性 | 向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色 |
| B | 证明铜与浓硫酸反应有SO2生成 | 将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口 |
| C | 比较Ksp(AgI)与Ksp(AgCl) 的大小关系 | 向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊 |
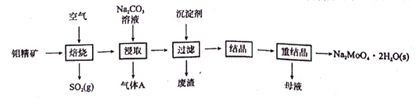
-
(1) 为了提高焙烧效率,除增大空气量外还可以采用的措施是(写一条即可),写出焙烧时生成MoO3的化学方程式。
-
(2) “浸取"时产生的气体A是。
-
(3) 若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为(填化学式)。
-
(4) “结晶”前需向滤液中加入Ba(OH)2 固体以除去CO32-。 若滤液中c(MoO42- )=0.40mol/L,c(CO32-)=0.20mol/L,要使钼元素无损失,CO32- 的最大去除率是[已知:Ksp(BaCO3)= 1.0×10-9 , Ksp(BaMoO4)=4.0×10-8]。
-
(5) 重结晶得到的母液可以在下次重结晶时亚复使用,但达到一定次数后必须净化处理,原因是。
-
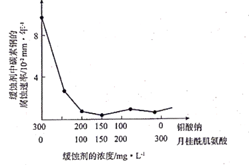
(6) 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。
 CH3COO-+H+
B . 亚硫酸氢钠在水溶液中的电离:NaHSO3═Na++H++
CH3COO-+H+
B . 亚硫酸氢钠在水溶液中的电离:NaHSO3═Na++H++  C . 氯化铵的水解:NH4++H2O
C . 氯化铵的水解:NH4++H2O  NH3·H2O+H+
D . 碳酸钙的溶解平衡:CaCO3(s)
NH3·H2O+H+
D . 碳酸钙的溶解平衡:CaCO3(s)  Ca2+(aq)+
Ca2+(aq)+  (aq)
(aq)
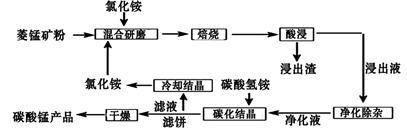
已知①菱锰矿粉的主要成分是MnCO3 , 还有少量的Fe、Al、Ca、Mg等元素②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
-
(1) “混合研磨”的作用为
-
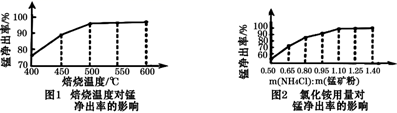
(2) 分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是:温度,m(NH4Cl):(锰矿粉)=。
-
(3) “焙烧”时发生的主要反应的化学方程式为
-
(4) 净化除杂流程如下
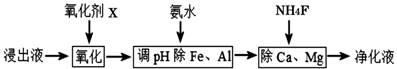
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+ , 常温下KMnO4能氧化盐酸产生氯气,则氧化剂X宜选择
A.(NH4)2S2O8 B.MnO2 C.KMnO4
②调节pH时,pH可取的范围为
③常温下Ksp(CaF2)=3.20×10-12;Ksp(MgF2)=7.29×10-11.当溶液中离子浓度小于或等于1×10-5mol/L时可认为离子沉淀完全。要使Ca2+和Mg2+都沉淀完全,沉淀后的溶液中F-的浓度不低于。
-
(5) “碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是
| A | B | C | D |
| | | | |
| 研究阳离子对H2O2分解速率的影响 | 研究沉淀的转化 | 研究酸碱性对平衡移动的影响 | 研究浓度对反应速率的影响 |

已知几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
请回答下列问题:
-
(1) 滤渣3的主要成分是(写出化学式);
-
(2) 用FeS还原Fe3+的目的是加入FeO的作用是(用离子方程式表示);
-
(3) 试剂R宜选择___________(填字母);A . 高锰酸钾 B . 稀硝酸 C . 双氧水 D . 次氯酸钠
-
(4) 检验“氧化”之后溶液是否含Fe2+的操作是;
-
(5) 已知沉淀溶解平衡:
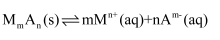 ,
,  。常温下,
。常温下,  ,“沉铁”中为了使
,“沉铁”中为了使 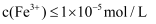 ,
,  最小为mol/L。
最小为mol/L。

已知:
①Ag、Cu、Fe的氧化物不溶于Na2S溶液
②硫浸后,锑砷以Na3SbS3、Na3AsS3存在;
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
-
(1) “硫浸”时,Sb2O3溶解的离子方程式为。
-
(2) 用NaNO3和NaOH浸取锑砷烟灰也可得到Na3SbO4 , 其缺陷是。
-
(3) “氧化”时所用H2O2的电子式为,反应温度不宜太高的原因是。
-
(4) “中和”时,生成NaSb(OH)6的化学方程式为,操作X为、过滤、洗涤、干燥。
-
(5) As2O3对应的酸为H3AsO3 , 测得某工业酸性废液中含H3AsO3和Fe2+ , 其浓度如表:
物质
H3AsO3
Fe2+
浓度/g·L-1
0.378
0.840
已知:Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21 , H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用方法除去该废水中的砷,除去砷后的废液中c(AsO
 )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
)=mol·L-1(不考虑反应过程中溶液体积的微小变化)
苦卤水 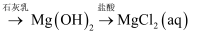

下列说法正确的是( )
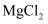 在阴极可得Mg
B . 将
在阴极可得Mg
B . 将 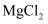 溶液蒸干可得无水
溶液蒸干可得无水 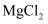 C . 反应
C . 反应 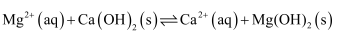 的
的  D . 常温下,
D . 常温下, 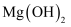 溶于盐酸所得
溶于盐酸所得 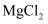 溶液中
溶液中 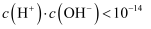
 的饱和溶液中存在着平衡
的饱和溶液中存在着平衡  ,加入
,加入 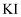 溶液,下列说法正确的是( )
溶液,下列说法正确的是( )
 减少
B . 溶度积常数
减少
B . 溶度积常数  增大
C . 沉淀溶解平衡不移动
D . 溶液中
增大
C . 沉淀溶解平衡不移动
D . 溶液中 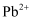 浓度减少
浓度减少
 )的关系如图所示。下列说法正确的是( )
)的关系如图所示。下列说法正确的是( )







