第四节 金属的电化学腐蚀与防护 知识点题库
下列方法中不能用于金属防腐处理的是( )
A . 制成不锈钢
B . 把金属制品埋入潮湿、疏松的土壤中
C . 喷油漆、涂油脂
D . 电镀
金属的防腐常用方法有:A.覆盖机油 B.覆盖油漆 C.覆盖塑料 D.电镀金属 E.电化学保护法 F.制成不锈钢.请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号):
(1)邮筒 (2)手术刀 (3)海水中的钢闸门
(4)电线 (5)铁钳的转动部位 (6)自行车的钢圈 .
铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是( )
A . 铁水龙头
B . 铜水龙头
C . 塑料水龙头
D . 陶瓷水龙头
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe2++4OH﹣ . 说法正确的是( )
A . 负极发生的反应为:Fe﹣3e﹣═Fe3+
B . 正极发生的反应为:2H2O+O2+2e﹣═4OH﹣
C . 原电池是将电能转变为化学能的装置
D . 钢柱在水下部分比在空气与水交界处更难腐蚀
下列事实与电化学原理无关的是( )
A . 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后,反应速率加快
B . 镀锡铁桶的镀层破损后,破损处很快会出现破洞
C . 轮船吃水线以下的船壳上装有一定数量的锌块
D . 铝片不用特殊方法保存
下列关于金属的腐蚀及防腐说法错误的是( )
A . 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快
B . 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极
C . 可以采用改变金属组成或结构的方法防止金属腐蚀
D . 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块
下列有关说法中不正确的是( )
A . 镀锌铁的镀层破损后,镀层仍然对铁起保护作用
B . 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C . Cl2与SO2使品红溶液褪色的原理相同
D . SiO2可用于制造光导纤维,其性质稳定,不溶于强酸,但是能溶于强碱
下列说法正确的是( )
A . 煤的干馏和煤的液化均是物理变化
B . 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用
C . 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积”
D . 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
-
(1) 图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母序号)
a.碳棒 b.锌板 c.铜板
B极需定期更换,写出电极反应方程式。

-
(2) 图2中,钢闸门C做极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为,检验该电极反应产物的方法是。
-
(3) 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的极(填“正”或“负”)。F电极上的电极反应式为。

-
(4) 乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为。
②若2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为mol。
2018年国家文物局对北洋海军军舰“经远舰”进行海上考古,考古队为舰体焊接锌块以实施保护。下列判断不合理的是()
A . 焊接锌块后的负极反应:Fe-2e-=Fe2+
B . 上述保护方法中可用镁合金块代替锌块
C . 腐蚀的正极反应:O2+2H2O+4e-=4OH-
D . 考古队采用的是牺牲阳极的阴极保护法
下列有关概念和原理的说法正确的是( )
A . 酸和碱反应只能生成盐和水
B . 由14N和中子在宇宙射线影响下形成12C 为化学变化: 14N+1n→ 12C+ 3H
C . 金属主要发生吸氧腐蚀,其本质是被氧化
D . Na2O2的水溶液能导电,所以Na2O2是电解质
下列有关金属腐蚀与防护的说法正确的是( )
A . 钢铁析氢腐蚀和吸氧腐蚀的速率一样快
B . 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C . 海轮外壳焊接锌块是采用了牺牲阳极的阴极保护法
D . 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,铸铁管的一种腐蚀图解如图所示。下列说法正确的是( )

A . 生成1molFeS,负极质量增加32g
B . 正极区溶液的pH变小
C . 正极电极反应式为:8H++8e-=8H·(吸附)、SO42-+8H·(吸附)+8e-  S2-+4H2O
D . 总反应:4Fe+4H2O+SO42-
S2-+4H2O
D . 总反应:4Fe+4H2O+SO42-  FeS+3Fe(OH)2+2OH-
FeS+3Fe(OH)2+2OH-
 S2-+4H2O
D . 总反应:4Fe+4H2O+SO42-
S2-+4H2O
D . 总反应:4Fe+4H2O+SO42-  FeS+3Fe(OH)2+2OH-
FeS+3Fe(OH)2+2OH-
化学在生产和日常生活中有着重要的应用。下列说法错误的是( )
A . 明矾水解形成的Al(OH)3胶体能吸附时水中悬浮物,可用于水的净化
B . 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C . MgO的熔点很高,可用于制作耐高温材料
D . BaCO3不溶于水,可用作医疗上检査肠胃的钡餐
下列事实与电化学无关的是( )
| | | | |
| A.暖宝宝(含铁粉、碳、氯化钠等)发热 | B.海沙比河沙混凝土更易使钢筋生锈 | C.家用铁锅生锈 | D.铁罐运输浓硫酸 |
A . A
B . B
C . C
D . D
下列有关电化学在生产、生活中的应用分析正确的是( )
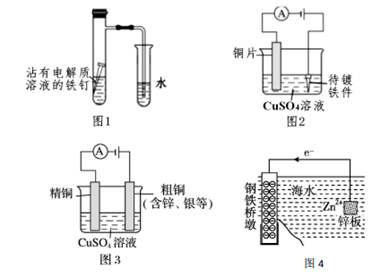
A . 图 1:导气管口有气泡冒出
B . 图 2:铁件上能发生的反应是: 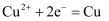 C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
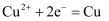 C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁制品发生电化学腐蚀的叙述正确的是( )
A . 该电化学腐蚀是析氢腐蚀
B . 正极反应式:  C . 原电池反应减缓了铁制品的腐蚀
D . 负极反应式:
C . 原电池反应减缓了铁制品的腐蚀
D . 负极反应式: 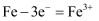
 C . 原电池反应减缓了铁制品的腐蚀
D . 负极反应式:
C . 原电池反应减缓了铁制品的腐蚀
D . 负极反应式: 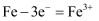
化学与科技生产、生活环境等密切相关,下列说法不正确的是( )
A . 电热水器用镁棒防止内胆腐蚀,利用了外加电源的阴极保护法
B . 明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有吸附性
C . 减少燃煤的使用改用风能太阳能等能源符合“低碳生活”理念
D . 市售暖贴的发热原理是利用原电池加快氧化还原反应速率
下列事实中,与电化学腐蚀无关的是( )
A . 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B . 为保护海轮的船壳,常在船壳上镶入锌块
C . 在空气中,金属银的表面生成一层黑色物质
D . 镀银铁制品,镀层部分受损后,露出的铁表面易被腐蚀
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如图。以下结论错误的是( )



A . 溶液pH≤2时,生铁发生析氢腐蚀
B . 在酸性溶液中生铁有可能发生吸氧腐蚀
C . 析氢腐蚀的速率比吸氧腐蚀快
D . 两溶液中负极反应均为:Fe-2e-=Fe2+
最近更新







