第四节 金属的电化学腐蚀与防护 知识点题库
如下图各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )

A . ④>②>①>③
B . ②>①>③>④
C . ④>②>③>①
D . ③>②>④>①
为防止碳素钢菜刀生锈,在使用后特别是切过咸菜后,应将其( )
A . 洗净、擦干
B . 浸泡在水中
C . 浸泡在食醋中
D . 直接置于空气中
为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )

A . 装置Ⅰ左侧的液面一定会上升
B . 左侧液面装置Ⅰ比装置Ⅱ的低
C . 装置Ⅱ中的铁钉腐蚀最严重
D . 装置Ⅲ中的铁钉几乎没被腐蚀
化学实验有助于理解化学知识,提升科学素养.
Ⅰ.某探究小组用以下右图装置做如下实验.
实验编号 | a中试剂 | b中试剂 |
|
1 | 0.1克Na、3mL水 | 0.1克Na、3mL乙醇 | |
2 | 3mL水 | 3mL饱和FeSO4溶液 |
-
(1) 实验1:同时加入试剂,反应开始阶段可观察到U形管中液面 (填编号,下同),
反应结束静置一段时间,最终U形管中液面 .
a.左高右低 b.左低右高 c.左右基本持平
-
(2) 实验2:一段时间后观察到U形管中液面左低右高,b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因: .
Ⅱ.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
-
(3) 请填满表中空格,以完成实验设计:
编号
实验目的
炭粉/g
铁粉/g
醋酸浓度/mol/L
①
作参照实验
0.5
2.0
1.0
②
探究醋酸浓度对实验的影响
0.5
0.1
③
0.2
2.0
1.0
-
(4) 实验①测得容器中的压强随时间的变化如图(2)所示.该小组得出0~t1时压强增大的主要原因是: .t2时,容器中压强明显变小的原因是 .请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向 .

下列说法正确的是( )
A . 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B . 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C . 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同
D . 无论哪种类型的腐蚀,其实质都是金属被氧化
如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
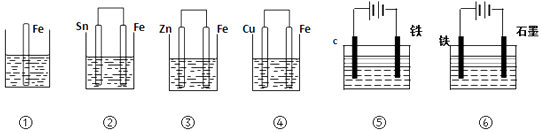
A . ④>②>①>③>⑤>⑥
B . ⑥>④>②>①>③>⑤
C . ④>②>⑤>③>⑥>①
D . ⑥>③>②>④>①>⑤
材料是人类赖以生存和发展的重要物质.
-
(1) 钢铁在潮湿的空气中易发生吸氧腐蚀,写出正极电极反应式;
-
(2) 水泥、玻璃都是传统的硅酸盐材料,生产水泥和玻璃都要用到的原料是 (填字母代号,下同);A . 石灰石 B . 小苏打 C . 烧碱
-
(3) 目前用量最大、用途最广的金属材料是 .A . 铜合金 B . 铝合金 C . 钢铁.
化学是材料科学发展的基础.请回答:
-
(1) 合金在生活中的应用很普遍,其优点是,常见的合金有.
-
(2) 金属的腐蚀使我们生活中常看到的现象.家用铁锅洗后容易生锈,请举出一种避免生锈的办法.
-
(3) 服用药物时要对症下药.以碳酸氢钠为主要成分的药物适合治疗.
-
(4) 蛋白质是生命的基础,没有蛋白质就没有生命.蛋白质的基石是.常利用(填“盐析”“变性”或“颜色反应”)分离、提纯蛋白质.
如图所示的钢铁腐蚀中下列说法正确的是( )

A . 碳表面发生氧化反应
B . 钢铁被腐蚀的最终产物为FeO
C . 生活中钢铁制品的腐蚀以图①所示为主
D . 图②中,正极反应式为O2+4e﹣+2H2O═4OH﹣
下列实验方案、现象和结论均正确的是( )
选项 | 实验方案 | 现象 | 结论 |
A |
| 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 | 该装置的气密性良好 |
B |
| 脱脂棉燃烧 | Na2O2与水反应生成氢氧化钠和氧气 |
C |
| 烧杯①的澄清石灰水先变浑浊 | NaHCO3比Na2CO3受热更易分解 |
D |
| U形管右端的液面高 | 铁钉发生吸氧腐蚀 |
A . A
B . B
C . C
D . D
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )

A . 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B . 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C . 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D . 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
下列叙述错误的是( )
A . 铁遇冷浓硝酸表面被钝化,可保护内部不被腐蚀
B . 船底镶嵌锌块,锌做负极,以防止船体被腐蚀
C . 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
D . 电解精炼铜时以纯铜作阴极,粗铜做阳极
下列叙述正确的是( )
A . 金属和石墨导电均为物理变化,电解质溶液导电也属于物理变化
B . 铅蓄电池的放电反应和充电反应互为可逆反应
C . 太阳能电池的主要材料是高纯度的二氧化硅
D . 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A . d为石墨,铁片腐蚀加快
B . d为石墨,石墨上电极反应为O2+2H2O+4e-=4OH-
C . d为锌块,铁片易被腐蚀
D . d为锌块,外电路中电子流向为锌块→铁片
下列有关生活生产中的叙述合理的是()
A . 铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液
B . 明矾和漂白粉分别用于自来水的净化和杀菌消毒,两者的作用原理相同
C . 水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法
D . 工业上合成氨采用500℃左右的温度,其原因是适当加快NH3 的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率
明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容:“∙∙∙∙∙∙黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间∙∙∙∙∙∙ ∙∙∙∙∙∙贸迁有无,∙∙∙∙∙∙”,下列解释正确的是( )
A . 明代使用的釜、鬵一类的炊具都属于青铜合金
B . 添加了铬、镍的不锈钢菜刀和农具使用后即使不保养,也不会生锈
C . 金属的另一个用途就是铸成钱币作为贸易交往中的流通手段
D . 黑铁在空气中发生的腐蚀主要是化学腐蚀
下列各个装置中铁棒被腐蚀由易到难的顺序正确的是( )

A . ③①②④
B . ④①③②
C . ①③②④
D . ②④①③
下列有关工业生产的叙述正确的是( )
A . 钢管被原油中的含硫化合物腐蚀是电化学腐蚀
B . 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C . 铁板镀锡属于电化学防护
D . 生铁浸泡在食盐水中发生吸氧腐蚀
化学与生产、生活密切相关。下列叙述不正确的是( )
A . 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极法
B . 人们洗发时使用的护发素具有调节头发pH使之达到适宜酸碱度的功能
C . 工业上处理废水时,只能使用可溶性硫化物(如Na2S)除去废水中的Hg2+
D . 蔗糖分子通过分子结构修饰,可得到三氯蔗糖,被认为是近乎完美的甜味剂,可供糖尿病患者食用
化学与社会、生产和生活密切相关。下列说法不正确的是( )
A . 研究高效合成氨有利于提高粮食产量
B . 大量鲜花的香味主要来自酯的混合物
C . 液化石油气是一种可再生的清洁能源
D . 采用喷涂油漆法可以防止钢铁的腐蚀
最近更新








