实验1-2 氯气的生成及其性质的微型实验 知识点题库

某小组同学欲探究NH3催化氧化反应,按下图装置进行实验.
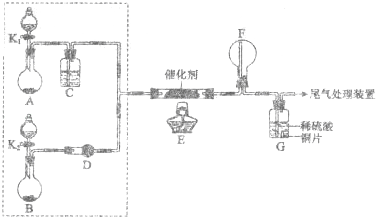
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是 ;
(2)装置B中产生气体的原因有(结合化学用语解释) ;
(3)甲乙两同学分别按上述装置进行实验.一段时间后,装置G中溶液都变成蓝色.
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是 ;
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式) ;
③用离子方程式解释装置G中溶液变成蓝色的原因: ;
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进.
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”) 装置A中的产气量,或(填“增加”或“减少”) 装置B中的产气量.
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号)
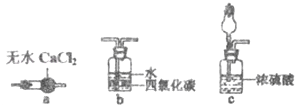
-
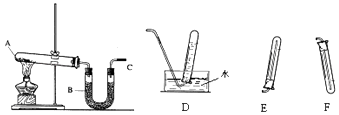
(1) 写出A处NH4Cl和Ca(OH)2反应的化学方程式:;
-
(2) 为收集到干燥的氨气C应接(填仪器编号);
-
(3) B中盛装的试剂是;
-
(4) 检验氨气是否集满的方法是;
-
(5) 在D,E,F三种气体收集方法中,能用于收集一氧化碳的是 装置.
-
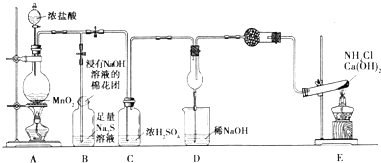
(1) 写出A中反应的离子方程式.
-
(2) 实验中证明氧化性Cl2>S的离子方程式为.
-
(3) D中干燥管中产生大量白烟,该反应的化学方程式为.
-
(4) 有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该装置中盛装的试剂名称为
-
(5) E装置中反应的化学方程式为.
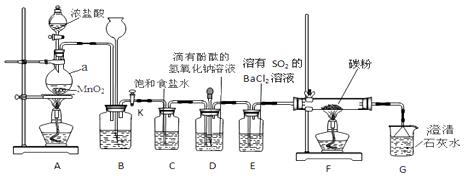
-
(1) 写出a仪器的名称.
-
(2) E装置产生白色沉淀现象的原因
-
(3) F装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl.试写出F中反应的化学方程式.
-
(4) G处反应过程中的现象.
a.一开始就有白色浑浊产生 b.开始无明显现象,然后产生白色浑浊
c.开始产生白色浑浊,一会儿浑浊消失 d.无明显现象
-
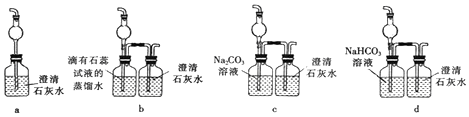
(5) G装置无法确认F处反应中有CO2产生,为了证明CO2的存在,要对G装置进行改造,下列装置符合要求的是.
-
(6) D处溶液红色褪去,产生该现象的原因可能有两种:
一是;
二是.
为确定是上述原因中的哪一种,请你设计一个简单的实验加以证明:.
-
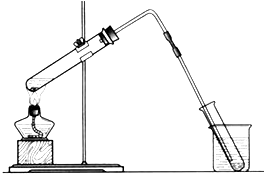
(1) 如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是,烧杯中还应盛装的物质是.
-
(2) 海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I﹣的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
①海带灼烧时用来盛装海带的仪器是(填仪器名称)
②已知KMnO4、H2O2、Cl2等均可与I﹣反应生成I2 , 且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl﹣ . 从绿色化学的角度看I﹣转化成I2 , 最好选 (上述三种中选择)
-
(3) 海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
①若只除去其中的不溶性杂质,应经过的实验步骤是、、.
②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
杂质
CaCl2
MgCl2
Na2SO4
除杂试剂
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42﹣是否除尽?
④上述除杂试剂加入的先后顺序应满足的一般条件是
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是,判断加入稀HCl适量的方法可以是.
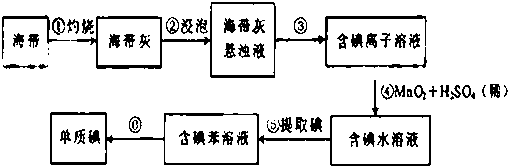
请填写下列空白:
-
(1) 步骤①灼烧海带时,除需要三角架外,还需要用到的仪器是 (从下列仪器中选择所需的仪器,用标号字母填写在空白处)A . 烧杯 B . 坩埚 C . 表面皿 D . 泥三角 E . 酒精灯 F . 干燥器
-
(2) 步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是.
-
(3) 步骤④反应的离子方程式是.
-
(4) 步骤⑤中,某学生选择用苯来提取碘的理由是.
Ⅰ.空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①Cl2+2Br﹣═Br2+2Cl﹣
②3Br2+3CO  ═BrO
═BrO  +5Br﹣+3CO2↑;
+5Br﹣+3CO2↑;
③BrO  +5Br﹣+6H+═3Br2+3H2O
+5Br﹣+6H+═3Br2+3H2O
其中②中的氧化剂是,③中的还原剂是.
Ⅱ.空气吹出SO2吸收法.该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.
写出溴与二氧化硫反应的化学方程式.
Ⅲ.溶剂萃取法.该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的.
实验室中萃取用到的主要实验仪器名称是.
下列可以用于海水中溴的萃取的试剂是(填序号).
①乙醇②四氯化碳③硝酸.
-
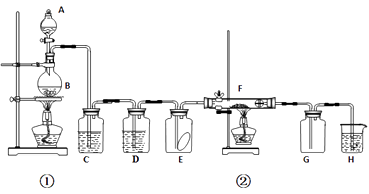
(1) A中所放试剂为,B中所放试剂为,二者反应的化学方程式为,该反应中的氧化剂是。
-
(2) C中试剂是;D中试剂的作用是。
-
(3) E中现象是; F中现象是,其反应的化学方程式为。
-
(4) F管中脱脂棉的作用是,H中试剂为。
-
(5) 整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是。(用①或②填写)。
-
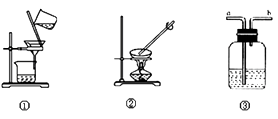
(1) 石灰水长时间露置于空气中,溶液表面会产生一层“膜”,“膜”物质的化学式是,可用上图中装置(填序号)进行相关实验操作除去膜物质。
-
(2) 提纯含有少量NaCl的KNO3 , 可将混合物溶解在热水中形成饱和溶液,然后在②装置中进行蒸发浓缩,后进行过滤、、干燥。
-
(3) 实验室制Cl2用装置③吸收尾气,集气瓶中可放入溶液,尾气应从通入(填a、b)。
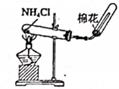


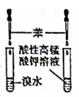
图1 图2 图3 图4
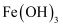 胶体:将NaOH溶液滴入饱和FeCl3溶液
胶体:将NaOH溶液滴入饱和FeCl3溶液
-
(1) 从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
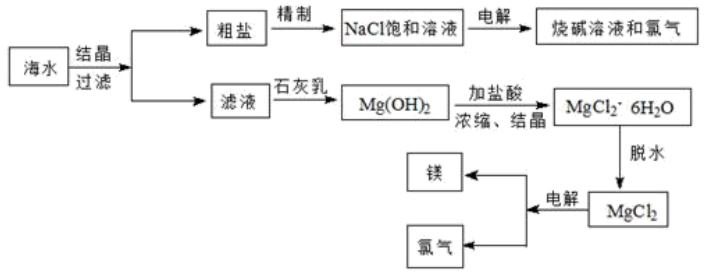
①若粗盐中含有杂质离子
 、
、 、
、 , 精制时所用试剂为:A.盐酸;B.
, 精制时所用试剂为:A.盐酸;B.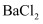 溶液;C.NaOH溶液;D.
溶液;C.NaOH溶液;D. 溶液。则加入试剂的顺序是(填序号)。
溶液。则加入试剂的顺序是(填序号)。②电解NaCl饱和溶液产生的NaOH和
 可用于制备对新冠病毒有效消杀的“84”消毒液,写出该反应的离子方程式:。
可用于制备对新冠病毒有效消杀的“84”消毒液,写出该反应的离子方程式:。③电解熔融
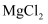 可制取镁和
可制取镁和 , 化学方程式为。其中
, 化学方程式为。其中 和
和 反应可制得漂白粉。漂白粉的有效成分是。
反应可制得漂白粉。漂白粉的有效成分是。 -
(2)
 (主要指NO和
(主要指NO和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的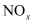 是环境保护的重要课题。在催化剂作用下,
是环境保护的重要课题。在催化剂作用下, 可与
可与 发生如下反应:
发生如下反应: 。
。
①该反应的氧化剂是,还原产物是。
②标准状况下生成
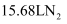 , 转移电子为mol。
, 转移电子为mol。

 B . 可用从左侧加水的方法检验装置②的气密性
C . 利用装置③验证铁的析氢腐蚀
D . 装置④随关随停制氨气
B . 可用从左侧加水的方法检验装置②的气密性
C . 利用装置③验证铁的析氢腐蚀
D . 装置④随关随停制氨气
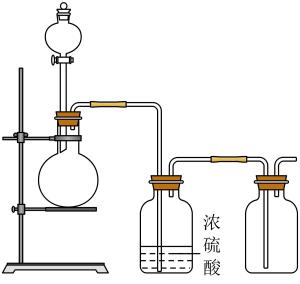
选项 | 化学试剂 | 制备的气体 |
A | C2H5OH+ H2SO4 (浓) | C2H4 |
B | MnO2+HCl(浓) | Cl2 |
C | MnO2 + H2O2 | O2 |
D | CaO+氨水(浓) | NH3 |



