实验2-2 海水的蒸馏 知识点题库
3,5−二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) /g·cm—3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5—二甲氧基苯酚 |
| 33~36 |
| 易溶于甲醇、乙醚,微溶于水 |
-
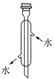
(1) 反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是。
②萃取时使用的主要仪器为。分离出该容器中的有机层的操作是。
-
(2) 分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是。
-
(3) 洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
-
(4) 固液分离常采用减压过滤。减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵,其目的是。

卫生的水。
-
(1) 硬水和软水可用来区分。硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。生活中可用方法来降低水的硬度。
-
(2) 硬水在加热或久置时,会产生水垢[主要成分是 Mg(OH)2和 CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式:、。
-
(3) 自来水生产过程中,可用方法除去水中不溶性杂质,同时还必须进行消毒杀菌。ClO2是一种新型的自来水消毒剂,其中氯元素与氧元素的质量比为:,氯的原子结构示意图为。
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 酒精(水) | 生石灰 | 蒸馏 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | 溴水 | 过滤 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |

-
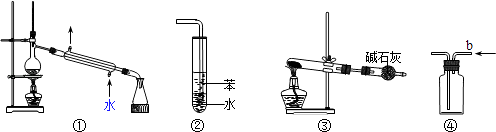
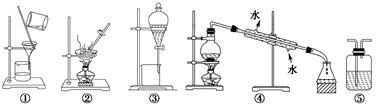
(1) 海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是(填序号);仪器⑤的冷凝水应从(填“a”或“b”)口进入。
-
(2) 海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的(填序号),该仪器名称为,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做。
 B . 石油的分馏
B . 石油的分馏  C . 验证溴乙烷发生消去反应
C . 验证溴乙烷发生消去反应  D . 氢氧化钠溶液滴定醋酸
D . 氢氧化钠溶液滴定醋酸 
| 选项 | A | B | C | D |
| 名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
| 图形 | | | | |
| 用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时仰视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用酒精萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL Na2CO3溶液 | 蒸馏实验中将蒸气冷凝为液体 |
-
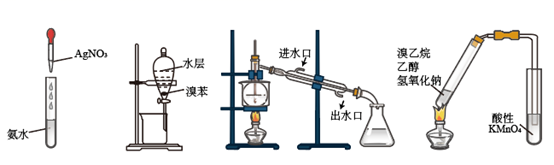
(1) 浓缩氧化:向酸化的浓缩海水中通入氯气,使澳离子转化为溴单质,离子方程式为;
-
(2) 富集提取:通入空气和水蒸气,将溴单质吹入盛有二氧化硫的溶液充分反应后再通入适量的氯气,最后用苯萃取分液可得粗溴。萃取分液时可选用以下实验装置中的(填字母序号),萃取剂还可选用(任填一种试剂);

-
(3) 产品精制:可用下图装置精制粗溴:

①仪器A的名称;
②图中冷却水应从B的(填“a”或“b”)口进入;
③装置D中NaOH溶液的作用是。

已知:
Ⅰ.FeCl2、FeCl3不溶于氯苯、二氯苯;
Ⅱ.C6H5Cl、C6H4Cl2二者互溶,不溶于水;沸点分别为132℃、173℃。
回答下列问题:。
-
(1) 仪器a的名称为,该仪器(填“能”或“不能”)用于石油的分馏。
-
(2) 该团队用3.25g FeCl3与过量氯苯反应,实验结束后将三颈烧瓶中的物质倒出,过滤、洗涤、干燥后得到粗产品,回收滤液中氯苯的方法为(填操作名称)。
-
(3) 经讨论后,分为甲、乙两组用不同方法测定FeCl3的转化率。
①甲组:用0.40mol·L-1NaOH标准液滴定锥形瓶内的溶液,可选用的指示剂为;若终点时消耗18.50mL NaOH标准液,则FeCl3转化率为%。
②乙组:将粗产品制成250mL溶液,取出25.00mL,用0.0200mol·L-1标准KMnO4溶液滴定(已知:本实验条件下,Cl-不参与反应:KMnO4还原产物为Mn2+)。达到滴定终点时的现象为,经平行实验测得平均消耗标准液16.00mL,则甲组测定结果(填“高于”或“低于”)乙组测定结果。
③某检测机构对粗产品进行测定,经数据分析测得FeCl3的转化率为79.95%。与乙组和检测机构的测定结果对比,若无操作失误,甲组产生较大误差可能的原因为。
|
A |
B |
C |
D |
|
|
|
|
|
|
除去 |
除去 |
分离苯和溴苯 |
制取无水 |
A | B | C | D |
|
|
|
|
实验室制氨气 | 蒸馏时的接收装置 | 除去 | 吸收多余的 |


 ;制备过程中还有
;制备过程中还有 等副反应。主要实验装置和步骤如图:
等副反应。主要实验装置和步骤如图:

I.合成:
在三颈烧瓶中加入20g无水AlCl3和30mL无水苯。边搅拌边慢慢滴加6mL乙酸酐和10mL无水苯的混合液,使反应液缓缓回流。滴加完毕后加热回流1小时,形成黑黄色液体。
Ⅱ.分离与提纯:
将冷却后的反应瓶置于冰水浴中,加入15mL苯,慢慢加入混合的盐酸冰水,静置分层,分液,无机相用乙醚萃取,与有机相合并,有机相用10%NaOH溶液洗涤,分液,弃去无机层,有机层用9mL水洗,分液,弃去无机层,有机层用MgSO4干燥,得到苯乙酮粗产品。
回答下列问题:
-
(1) 仪器a的名称:;使用恒压滴定漏斗的优点是:。
-
(2) 若将乙酸酐和苯的混合液一次性倒入三颈烧瓶,可能导致____。A . 反应太剧烈 B . 液体太多搅不动 C . 反应变缓慢 D . 副产物增多
-
(3) 分离和提纯操作中是否可改用乙醇萃取?(填“是”或“否”),原因是。
-
(4) 分液漏斗使用前须并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振荡并放气后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先打开上口玻璃塞,然后打开活塞放出下层液体,上层液体。
-
(5) 已知常压下:
熔点/℃
沸点/℃
苯
5.5
80.1
乙醚
-116.3
34.6
苯乙酮
19.6
202
则从粗产品中提纯苯乙酮使用的操作方法是。




 中少量
中少量
 溶液中的
溶液中的 胶体
胶体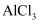

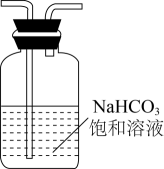

 中少量
中少量


