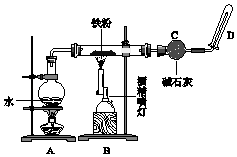
实验2-4 硫酸亚铁铵的制备 知识点题库
-
(1) 装置A的作用是.
-
(2) B中反应的化学方程式:.
-
(3) 碱石灰的作用是.
-
(4) 在D处玻璃管口点燃生成的气体前,必须对该气体进行,这一操作的目的是.
-
(5) 当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是 L.
-
(1) 配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。
①用化学用语解释FeCl3溶液呈酸性的原因:。
②下列实验方案中,能使FeCl3溶液pH升高的是(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
-
(2) 小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作
现象
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L−1的FeCl3溶液,搅拌
溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体
收集检验反应过程中产生的气体
集气管口靠近火焰,有爆鸣声
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:。
② 用离子方程式解释反应后溶液为浅绿色的原因:。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是。
-
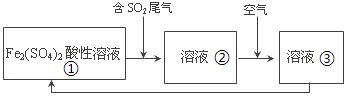
(3) 为进一步探究上述1.0 mol·L−1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作
现象
将5 mL 1.0 mol·L−1的FeCl3溶液与0.65 g锌粉混合
溶液温度迅速上升,开始时几乎没有气泡
将与0.65 g锌粉混合
溶液中立即产生大量气泡
小组同学得出结论:在1.0 mol·L−1 FeCl3溶液中,Fe3+的氧化性比H+更强。

下列说法正确的是( )
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
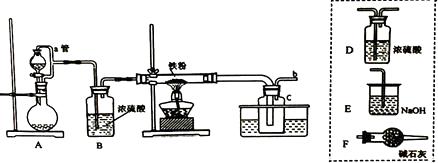
氯化亚铁:熔点670℃, 易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。
-
(1) 装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为。
-
(2) 弯曲的a管所起的作用是;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是。
-
(3) 导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
-
(4) 实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为%。
-
(5) 由上分析数据和计算得出结论:
①用此装置制得的无水氯化铁含铁偏高,偏低),显然其中含有较多的杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是。
Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。
Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。
Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。
Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)2•6H2O。
V.将(NH4)2Fe(SO4)2•6H2O脱水得(NH4)2Fe(SO4)2 , 并进行热分解实验。
已知在不同温度下FeSO4•7H2O的溶解度如表:
|
温度(℃) |
1 |
10 |
30 |
50 |
|
溶解度(g) |
14.0 |
17.0 |
25.0 |
33.0 |
回答下列问题:
-
(1) 步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是,步骤Ⅱ中设计铁粉过量,是为了,加热反应过程中需不断补充蒸馏水的目的是。
-
(2) 步骤Ⅲ中称量反应后剩余铁粉的质量,是为了。
-
(3) (NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。

①检验气态产物中的SO2和SO3时,装置连接顺序依次为(气流从左至右);C中盛放的试剂为。
②装置A的作用是。
③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为。
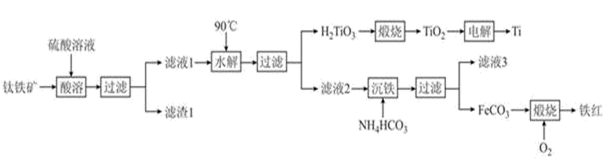
已知:酸溶时,FeTiO3转化为Fe2+和TiO2+
-
(1) FeTiO3中Ti元素的化合价为价,铁红的用途为(任写一种)。
-
(2) “水解”中,发生反应的离子方程式为。
-
(3) “沉铁”中,生成的酸性气态产物的电子式为;该过程控制反应温度低于35℃,原因为。
-
(4) FeCO3转化为铁红时,发生的化学方程式为。
-
(5) 制得的FeCO3可加入足量的稀硫酸,则从溶液中获得绿矾的操作是。
-
(6) 电解生产钛时用TiO2 和石墨做电极,电解质为熔融的CaO,则阴极的反应式为。
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向 3ml0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液 | 先出现白色沉 淀后出现黄色 沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 将某气体通入品红溶液 | 品红溶液褪色 | 该气体是 SO2 |
| C | 用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH | 后者 pH比前者 的小 | 非金属性:Cl>C |
| D | 将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中 | 溶液变蓝 | 氧化性Fe3+>Cu2+ |

-
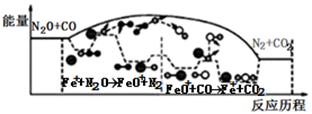
(1) “浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2 , O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为。
②加入硫酸的目的是;加入活性炭能降低有害气体的产生,这是因为。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2 -
(2) “制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是;写出生成FePO4·2H2O的离子方程式:。
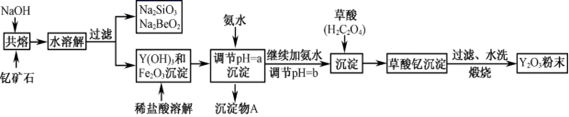
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
-
(1) 写出Na2SiO3的一种用途。
-
(2) 若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为。
-
(3) 根据元素周期表的知识判断,常温下,氯化锶溶液pH7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:。
-
(4) 欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式。
-
(5) 为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在范围内;继续加氨水调节pH =b发生反应的离子方程式为;检验Fe3+是否沉淀完全的操作方法是:。
-
(6) 煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式。
-
(1) (一)铁红制备的流程图分析:
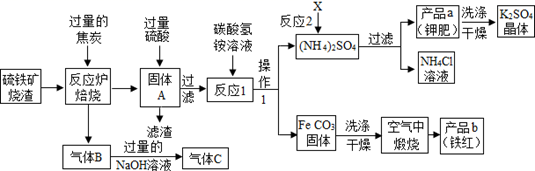
若焙烧中碳与四氧化三铁反应后B中气体的比例恰好是1:1,其化学方程式:。
-
(2) 实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和(填仪器名称)。
-
(3) 你认为对气体C最佳的处理方法是________(填选项序号)。A . 冷却后排入空气 B . 燃烧后排放 C . 再通入反应炉
-
(4) 反应1的反应温度一般需控制在35℃以下,其目的是。
-
(5) 反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:。
物质
X
K2SO4
NH4Cl
(NH4)2SO4
溶解度g(25℃)
34.0
11.1
37.2
19.2
洗涤干燥得到硫酸钾晶体时,可选用下列(选填序号,下同)洗涤剂
A.氯化钾饱和溶液B.水C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入,振荡、静置,再向上层清液中滴加,观察现象即可判断。
A.硝酸银溶液B.过量的氯化钡溶液C.过量的硝酸钡溶液
-
(6) (二)铁红的性质实验
实验装置:已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O
 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O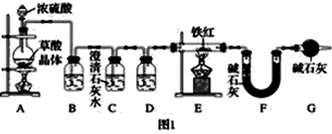
①实验前应先。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是、(填字母编号)。
A.浓硫酸B.澄清的石灰水C.氢氧化钠溶液
③C装置的作用是。
| 操作和现象 | 结论 | |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp (AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
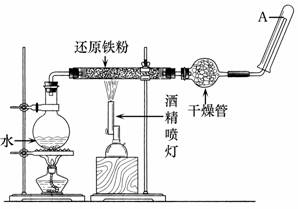
请回答该实验中的问题。
-
(1) 写出该反应的化学方程式。
-
(2) 实验前必须对整套装置进行的操作是。
-
(3) 干燥管中盛装的物质可以是,作用是。
-
(4) 试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是。
回答下列问题:
-
(1) 加热沉淀时发生反应的化学方程式为,所得残渣的颜色为。
-
(2) 铁氧化物(FexOy)的化学式为,所加NaOH溶液的体积为mL。
-
(3) 向溶液X中加入足量铁粉制备绿矾(化学式为FeSO4·7H2O,相对分子质量278),不考虑产品损失,最多能够制备多少克绿矾?(无解题过程不给分)
 )和摩尔盐[
)和摩尔盐[ ]的抗氧化能力,装置如图所示。
]的抗氧化能力,装置如图所示。

标准状况下,向两支注射器中分别放入0.01mol绿矾晶体和0.01mol摩尔盐晶体,向右拉动注射器活塞,各吸入20mL空气,关闭注射器针头连接的止水夹,均放置4h,取出两种晶体,用无氧蒸馏水溶解并配制成100mL溶液,实验结果如下表所示:
|
实验操作 |
装置1的现象 |
装置2的现象 |
|
放置4h后活塞向左移动的距离 |
较长 |
较短 |
|
取2mL配制的溶液,滴加2滴KSCN溶液 |
溶液变为深红色 |
溶液变为浅红色 |
|
取2mL配制的溶液,滴加足量的 |
产生较少的蓝色沉淀 |
产生较多的蓝色沉淀 |
已知:相同条件下,消耗 的量越多,抗氧化能力越强。
的量越多,抗氧化能力越强。
下列推断正确的是( )

-
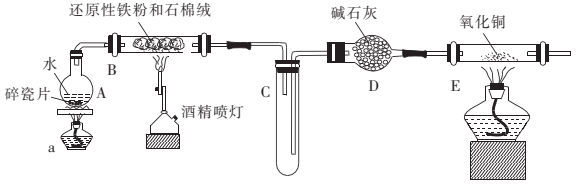
(1) 装置A的作用是。
-
(2) 硬质玻璃管B中发生反应的化学方程式为。
-
(3) 实验中先点燃酒精灯a再点燃酒精喷灯,可能的原因是。
-
(4) 装置E中的现象是。
-
(5) 利用反应后的固体物质进行如图实验:
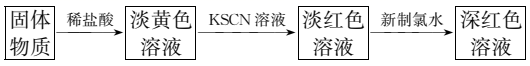
①某同学发现实验中加入过量新制氯水,放置一段时间后,深红色会逐渐褪去,褪色后的溶液中继续滴加KSCN溶液,又出现红色,则褪色的原因可能是。
②该同学将上述实验中的新制氯水改为H2O2溶液,也能出现深红色溶液,用离子方程式表示溶液颜色加深的原因:。
③电子工业中,人们常用FeCl3溶液腐蚀铜板来制作印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:。

回答下列问题:
-
(1) 湿棉花的作用是。
-
(2) 该反应的化学方程式是。
-
(3) 利用上述反应后的固体制备无水
 , 设计流程如图所示:固体
, 设计流程如图所示:固体 滤液
滤液 ……
…… 无水FeCl3
无水FeCl3①固体和盐酸反应的化学方程式是。
②通入
 的作用是。
的作用是。③
 会腐蚀钢铁设备,除
会腐蚀钢铁设备,除 作用外,另一主要原因是(用离子方程式表示)。
作用外,另一主要原因是(用离子方程式表示)。④
 可做净水剂原因是,与处理中性废水相比,
可做净水剂原因是,与处理中性废水相比, 处理强酸性废水的效果(填“更好”“更差”或“无差别”)。
处理强酸性废水的效果(填“更好”“更差”或“无差别”)。
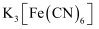 溶液
溶液


