实验2-4 硫酸亚铁铵的制备 知识点题库
-
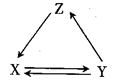
(1) 按图Ⅰ所示装置,用两种不同的操作分别进行实验,观察B管中的现象。
①操作1:先夹紧止水夹a,再使A管开始反应,实验中观察到B管中的现象是
。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,实验中观察到B管
中的现象是。
③请说明造成两种操作现象不同的原因(如两种现象相同,此小题不用回答):
。
-
(2) 上述装置实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅
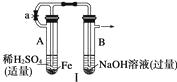
烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
① 用方程式表示试管甲产生白色沉淀的原因。
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式
。
③图Ⅱ中丙装置的作用是。
实验结束时,在装置丙中观察到的现象是。
-
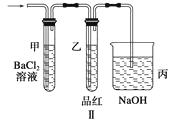
(1) 装置B中发生反应的化学方程式是.
-
(2) E中出现的现象是.
-
(3) 该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液中含有Fe3+ , 选用的试剂为,现象是.
②该实验小组同学用上述试剂没有检测到Fe3+ , 用离子方程式解释滤液中不存在Fe3+可能的原因:.
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的.
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是.
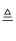 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑ 请回答:
-
(1) 将FeSO4受热产生的气体按图示装置进行实验,证实含有SO3和SO2 . 能说明SO2存在的实验现象是;为测定BaSO4沉淀的质量,后续的操作步骤依次为、洗涤、干燥、称重.
-
(2) 设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应).

请回答该实验中的问题.
-
(1) 写出该反应的化学方程式.
-
(2) 实验前必须对整套装置进行的操作是.
-
(3) 圆底烧瓶中盛装的是水,该装置受热后的主要作用是.
-
(4) 试管中要收集干燥的气体,干燥管中盛装的物质是,作用是.
-
(5) 试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是.

-
(1) 现将少量Fe2O3粉末加入适量稀盐酸,发生反应的离子方程式,用所得溶液进行以下实验:
-
(2) 取少量溶液于试管中,滴入NaOH溶液,观察到有红褐色沉淀生成,反应的离子方程式为。
-
(3) 取少量溶液于试管中,加入少量还原铁粉,振荡,铁粉逐渐溶解,溶液由黄色变为浅绿色,反应的离子方程式为。
-
(4) 在烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中滴加几滴FeCl3饱和溶液,继续煮沸直到溶液呈红褐色,即得到Fe(OH)3胶体。取少量Fe(OH)3胶体,逐滴加入盐酸至过量,可观察到的现象是:先,然后,对后一现象的解释是(用离子方程式表示)。
| X | Y | Z | 物质转化关系 | |
| A | Cu | CuO | Cu(OH)2 | |
| B | Si | SiO2 | H2SiO3 | |
| C | NaHCO3 | Na2CO3 | NaOH | |
| D | FeCl2 | FeO | FeCl3 |
(查阅资料)铁、铜不与氢氧化钠溶液反应。
-
(1) (猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有(填名称)。
-
(2) (实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案
实验现象
结论
①取一定量的合金粉末,加过量的,充分反应后过滤,滤渣备用。
粉末部分溶解,并有气体放出。
合金中一定含有铝。
②取步骤①所得滤渣,加过量的,充分反应。
滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。
合金中一定含有。
-
(3) (探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式。
-
(4) (知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式。

-
(1) “氧化”步骤发生的离子方程式为:, 使用双氧水作氧化剂优点为:。
-
(2) “热分解”得到的产物除了氧化铝外,还有 NH3、N2、SO2、SO3、H2O 生成,则氧化 产物和还原产物的物质的量之比为。
-
(3) 铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值( 失重计算值(%)=
 )如表所示:
)如表所示: 温度区间(℃)
18→190
190→430
430→505
505→900
失重计算值(%)
39.20
7.80
13.00
26.00
通过上述数据经粗略计算可判断,在温度区间铵明矾基本上失去了全部结晶水。
-
(4) “结晶”步骤中常采用的操作是
-
(5) 该流程中常使用过量的工业硫酸铵,利用硫酸铵水解使溶液显酸性抑制硫酸铝水解, 这样做的目的是:。
-
(6) 通常认为金属离子浓度等于 1×10-5mol/L 即可认为沉淀完全,试计算常温下“中和”步 骤中需要调节溶液 pH=(保留一位小数,已知:Ksp[Fe(OH)3 ]=8.0×10-38 , lg5=0.7)。
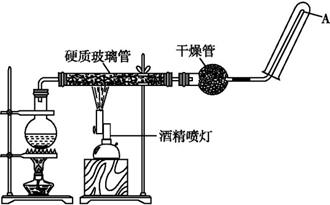
-
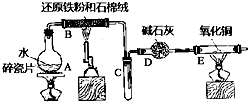
(1) 该反应的化学方程式为。
-
(2) 圆底烧瓶中装的是水,该装置的主要作用是;烧瓶底部放了几片碎瓷片,碎瓷片的作用是。
-
(3) 干燥管中盛装的物质是,作用是。
-
(4) 如果要在A处玻璃管口点燃该气体,则必须对该气体进行,方法是。
 B .
B .  C .
C .  D .
D . 
-
(1) Ⅰ.为探究SO2气体的还原性,某实验小组的同学利用如下图所示装置进行实验。
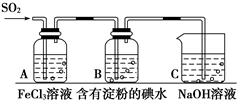
装置A中发生反应的离子方程式为。
-
(2) 装置C的作用是。
-
(3) 在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液少量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②:向第二份溶液中加入少量KSCN溶液,发现不变红,再加入少量新制的氯水,溶液变红。上述方案中不合理的是,原因是。
-
(4) Ⅱ.无水FeCl3在空气中易潮解,遇水水解,加热易升华。实验室可用下列装置制备。
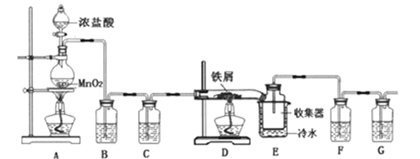
反应开始后,装置D硬质玻璃管中出现的现象为。
-
(5) 装置F中所盛的试剂为。
-
(6) 下列有关该实验的说法中,错误的是___________A . B装置的作用是除去HCl,并能减少Cl2的溶解 B . E装置中冷水的作用是冷却,使FeCl3冷却沉积 C . 若氯气不足则会产生FeCl2 D . 向烧瓶中加入足量的AgNO3和稀硝酸,可确定生成的MnCl2的质量
-
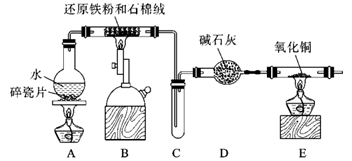
(1) A装置的作用是,烧瓶底部放碎瓷片的作用是。
-
(2) 装置B中发生反应的化学方程式是。
-
(3) D的作用是。
-
(4) E中的实验现象是。
-
(5) 请设计实验检验装置B的产物中是否存在+3价的铁。
回答下列问题:
-
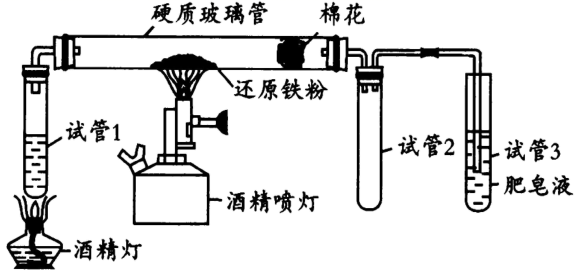
(1) 写出铁和水蒸气反应的化学方程式,并用双线桥表明电子转移的方向和数目;试管2的作用是。
-
(2) 酒精灯与酒精喷灯点燃顺序为,理由是。
-
(3) 通过点燃试管3中产生的肥皂泡,来检验生成的气体,肥皂液的作用是。
-
(4) 检验反应后的固体是否存在Fe3O4 , 引起小组成员争论:
①甲同学认为可以使用化学方法,先用足量盐酸溶解,再分别检验Fe2+和Fe3+。大家认为该方法不合理,请写出至少1条理由;
②乙同学认为可以利用Fe3O4的磁性检验。由于铁粉和生成的Fe3O4难以分离鉴别,乙同学查阅资料之后,用极细钢丝网代替铁粉进行实验。在实验前后分别剪下少量钢丝,用铁片靠近钢丝,观察到现象,证明了反应后的固体中含有Fe3O4。
 的工艺流程如下:
的工艺流程如下:
回答下列问题:
-
(1) 黄钠铁矾
 中,铁的化合价为价;黄钠铁矾能净水的原因是。
中,铁的化合价为价;黄钠铁矾能净水的原因是。
-
(2) 过滤操作时要遵循“一贴、二低、三靠”的原则,其中“二低”指的是滤纸边缘略低于漏斗口、。
-
(3) “沉铁”过程加入Na2CO3的目的是,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的Na2CO3偏多,则所得黄钠铁矾中混有的杂质是(填化学式);检验沉铁反应是否完全的方法是。

-
(4) “转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4 , 控制溶液中NaOH的浓度,可得到不同晶态物质(
 、Ni或二者的混合物)。当生成
、Ni或二者的混合物)。当生成 和Ni的物质的量之比为1:2时,该反应的离子方程式为;在其他条件不变的情况下,随NaOH浓度增大,产物中Ni的含量增加,原因是。
和Ni的物质的量之比为1:2时,该反应的离子方程式为;在其他条件不变的情况下,随NaOH浓度增大,产物中Ni的含量增加,原因是。
-
(5) 化学镀镍是金属表面镀镍的常用方法,以NiSO4为镀液,次亚磷酸钠(NaH2PO2)为还原剂,在90℃的酸性溶液中发生反应,NaH2PO2被氧化为亚磷酸(H3PO3)。写出化学镀镍反应的离子方程式:。

下列说法错误的是( )
 +3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
+3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
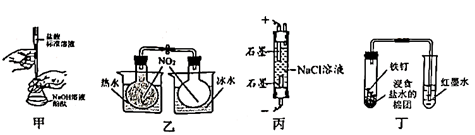
 溶液的浓度
B . 用图乙装置可探究温度对
溶液的浓度
B . 用图乙装置可探究温度对 平衡体系的影响
C . 用图丙装置可制得消毒剂
平衡体系的影响
C . 用图丙装置可制得消毒剂 同时减少
同时减少 的逸出
D . 用图丁装置可验证铁钉发生了析氢腐蚀
的逸出
D . 用图丁装置可验证铁钉发生了析氢腐蚀