实验3-5 比色法测定抗贫血药物中铁的含量 知识点题库
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(aq,红色)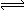 H+(aq)+In-(aq,黄色)而用作酸碱指示剂.往该溶液中加入Na2O2粉末,则溶液颜色为( )
H+(aq)+In-(aq,黄色)而用作酸碱指示剂.往该溶液中加入Na2O2粉末,则溶液颜色为( )
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l) SO32-+SO2+ . 若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是 ( )
SO32-+SO2+ . 若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是 ( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )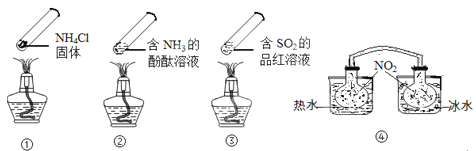
 N2O4△H<0)
D . 四个“封管实验”中所发生的化学反应都是可逆反应
N2O4△H<0)
D . 四个“封管实验”中所发生的化学反应都是可逆反应
步骤 Ⅰ 称取样品1.500 g。
步骤 Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤 Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
-
(1) 根据步骤 Ⅲ 填空:①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察(填序号)。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色,且半分钟内不褪色。
-
(2) 滴定结果如下表所示:
滴定
次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
若NaOH标准溶液的浓度为0.1010 mol·L-1则该样品中氮的质量分数为。
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
编号 | 实验事实 | 实验结论 |
A | 某溶液能使酚酞溶液变红 | 该溶液一定是NaOH溶液 |
B | 某物质可以导电 | 该物质一定是金属单质 |
C | 常温下,测定某溶液的pH=3 | 该溶液一定呈酸性 |
D | 某气体不能使带火星的木条复燃 | 该气体一定不含氧气 |
花的种类 | 花汁在酒精中的颜色 | 花汁在稀酸中的颜色 | 花汁在稀碱中的颜色 |
玫瑰 | 粉色 | 粉色 | 绿色 |
万寿菊 | 黄色 | 黄色 | 黄色 |
大红花 | 粉色 | 橙色 | 绿色 |
请回答:
-
(1) 以上所举的花中不能作酸碱指示剂的是.
-
(2) 经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为.
以下说法正确的是( )
某校化学课外活动小组进行测定果汁中维生素C含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
⑴实验目的:测定××牌软包装鲜橙汁维生素C含量。
⑵实验原理:C6H8O6+I2→C6H6O6+2H++2I-。
⑶实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3mol・L-1的标准碘(水)溶液,指示剂,蒸馏水等。
⑷实验过程:
①洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤的仪器有。用标准液润洗的仪器是。
②打开橙汁包,目测:颜色―橙黄色,澄清度―好,将酸式滴定管用橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是。
③用左手操作滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化。滴定至终点时的现象是。
⑸数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是mg·L-1。
⑹记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果。(填“偏高”“偏低”或“无影响”)。
⑺从测定结果看,此软包装橙汁是否是纯天然橙汁(填序号)
A.可能是 B.一定是 C.不是
-
(1) 将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有。
-
(2) 取待测液10.00 mL,用滴定管量取,并置于锥形瓶中。
-
(3) 向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):。①石蕊试液 ②无色酚酞 ③甲基橙试液
-
(4) 根据两次滴定获得的实验数据如下表,得出烧碱的纯度为。
滴定次数
待测液体积(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
4.00
24.10
-
(5) 下列操作中可能使所测烧碱溶液的浓度数值偏低的是(选填字母)。
A 酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B 锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C 装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定
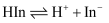 , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )
, 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )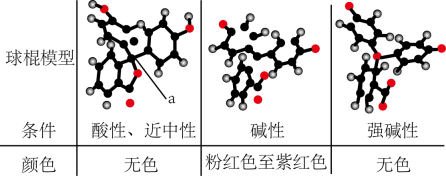
(图中环状结构为苯环)
 杂化转化为
杂化转化为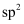 杂化
C . 当指示剂的
杂化
C . 当指示剂的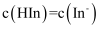 , 则
, 则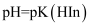 , 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变
, 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变
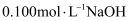 溶液分别滴定
溶液分别滴定 的盐酸和醋酸,滴定曲线如图所示,下列说法错误的是( )
的盐酸和醋酸,滴定曲线如图所示,下列说法错误的是( )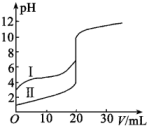
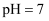 时,滴定醋酸溶液消耗的
时,滴定醋酸溶液消耗的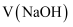 等于
等于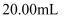 C . 滴定醋酸溶液过程中,当消耗
C . 滴定醋酸溶液过程中,当消耗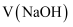 等于
等于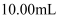 时,此时溶液中
时,此时溶液中 D . 滴定醋酸溶液、盐酸时,均可选择酚酞溶液作为指示剂
D . 滴定醋酸溶液、盐酸时,均可选择酚酞溶液作为指示剂



