实验3-5 比色法测定抗贫血药物中铁的含量 知识点题库
(2)有两份等体积的0.1mol/L的醋酸溶液,分别用蒸馏水和0.1mol/L的醋酸钠溶液稀释100倍,用0.1mol/L的醋酸钠溶液稀释后的溶液pH较 (填:“大”或“小”)原因:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
-
(1) 操作F中应该选择图中 滴定管(填标号)。
-
(2) 滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
-
(3) 滴定结果如表所示:
滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
①
20
1.02
21.03
②
20
2.00
25.00
③
20
0.60
20.59
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
-
(4) 该盐酸的浓度为mol/L。
-
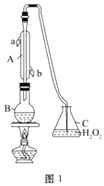
(1) 仪器A的名称是,水通入A的进口为。
-
(2) B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。
-
(3) 除去C中过量的H2O2 , 然后用0.090 0 mol·L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
-
(4) 滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为g·L-1。
-
(5) 该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:。
实验I.草酸根含量的测定
称取0.9820g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358K,用0.2000mol/L KMnO4溶液滴定,滴定过程中草酸转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4 溶液12.00 mL。
实验II. 铁含量的测定
将上述滴定过的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液作指示剂,用0.2500mol/LNa2S2O3标准溶液滴定至终点。共消耗Na2S2O3溶液8.00mL.(已知: 实验II中涉及的部分离子方程式为I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题:
-
(1) 实验I在滴定过程中反应的离子方程式为。
-
(2) MnO4-在酸性条件下,加热能分解为O2 , 同时生成Mn2+ , 若实验II中没有对实验I的保留液进行充分加热,则测定的Fe3+的含量将会(填“偏高”、“偏低”或“不变”。)
-
(3) 实验II用淀粉溶液作指示剂,则滴定终点观察到的现象为。

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
-
(1) 发生器中鼓入空气的作用可能是。
a.将SO2氧化成SO3 , 增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
-
(2) 吸收塔内发生反应的化学方程式为。
-
(3) 吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是(填序号)。
a.Na2O2
b.Na2S
c.FeCl2
-
(4) 从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是。
-
(5) 某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为(用含m、c、V的代数式表示,结果化成最简)
-
(1) Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
③
加入试剂
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L
H2C2O4溶液
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
草酸与酸性高锰酸钾的反应的离子方程式为:
-
(2) 实验①②结论是。
-
(3) 实验②选用MnSO4固体而不是MnCl2固体的原因是。
-
(4) 该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为。
-
(5) Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
c中加入的指示剂可选用,恰好完全反应时的现象是。
-
(6) 若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会(填“偏高”、“偏低”或“没有影响”)。
-
(7) 根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)mg·kg-1(计算结果保留整数即可)。
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
| 选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
| A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
| B | HCl溶液 | 氨水 | 甲基橙 | 黄色→橙色 |
| C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
| D | 碘水 | Na2S溶液 | 淀粉 | 蓝色→无色 |
-
(1) 酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作符合题意。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
-
(2) 氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数
待测液体积
(mL)
标准KMnO4溶液体积(mL)
滴定前读数
滴定后读数
第一次
25.00
0.50
20.40
第二次
25.00
3.00
23.00
第三次
25.00
4.00
24.10
①滴定时发生的离子反应方程式,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是。
②该草酸溶液的物质的量浓度为。
-
(3) 沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白
浅黄
白
砖红
白
Ksp
1.77×10-10
5.35×10-13
1.21×10-16
1.12×10-12
1.0×10-12
A . NaCl B . NaBr C . NaCN D . Na2CrO4
已知:Ksp(HgS)=4.0×10-5。
|
(CN)2 |
沸点为-21.2℃,熔点为-34.4 ℃,化学性质与卤素单质相似,有剧毒,燃烧时火焰星紫红色,边缘略带蓝色 |
|
CS2 |
沸点为 46. 5℃,熔点为-111.9℃,能与酯互溶 |

回答下列问题:
-
(1) 仪器a的名称为。
-
(2) 已知Hg(SCN)2微溶于水,可由KSCN溶液与Hg(NO3)2溶液反应制得,若以Fe3+作指示剂,则当溶液变为色时,Hg2+沉淀完全。
-
(3) 待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为CS2 , CS2可用于制造人造丝、杀虫剂,请举出一种其在实验室中的用途。
-
(4) 取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为。
-
(5) 取下D装置,将燃着的镁条伸入瓶中,镁条会继续燃烧,取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,则证明Hg(SCN)2分解产物中含有。
-
(6) 取出A中剩余固体,加水溶解,固体不溶,加入王水固体溶解,则证明含有HgS。记溶解后的溶液为X。该固体(填“能”或“不能")溶于稀盐酸,原因是。
-
(7) 经上述推断,写出Hg(SCN)2分解的化学方程式。
-
(8) 若要测定Hg(SCN)2的分解率,可用NH4SCN滴定法测定溶液X中离子浓度。
已知:①3HgS+2HNO3+12HCl=3H2[HgCl4]+3S↓+2NO↑+4H2O;
②H2[HgCl4]+2SCN-=Hg(SCN)2↓+4Cl-+2H+;
③NH4SCN标准溶液中含有NH4Fe(SO4)2指示液。
若取上述溶液X,用浓度为c mol/L的NH4SCN标准溶液进行滴定,消耗V mL,忽略反应前后溶液体积变化,原Hg(SCN)2固体质量为m g,滴定终点的现象为,Hg(SCN)2的分解率为。
甲基橙:3.1~4.4 石蕊:`5.0~8.0 酚酞:8.2~10.0
用0.1000 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时。下列叙述正确的是( )
 ]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氢气制备 , 装置如图所示(夹持和搅拌装置已省略)。
, 装置如图所示(夹持和搅拌装置已省略)。
回答问题:
-
(1) 实验室用
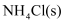 和
和 制备氨气的化学方程式为。
制备氨气的化学方程式为。
-
(2) 现有浓
 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓 mL(保留一位小数)。
mL(保留一位小数)。
-
(3) 装置中活塞
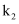 的作用为。实验过程中,当出现现象时,应及时关闭
的作用为。实验过程中,当出现现象时,应及时关闭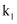 , 打开
, 打开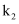 。
。
-
(4) 当溶液pH为8.0~9.0时,停止通
 , 即可制得
, 即可制得 溶液。若继续通入
溶液。若继续通入 , 当
, 当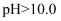 时,溶液中
时,溶液中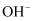 、和(填离子符号)浓度明显增加。
、和(填离子符号)浓度明显增加。
-
(5) 若本实验不选用pH传感器,还可选用作指示剂,当溶液颜色由变为时,停止通
 。
。



