第四单元 研究型实验 知识点题库
铝 | 镁 | |
A.与非金属反应 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
B.与水反应 | 常温下难与水反应 | 常温下能与水缓慢反应 |
C.与碱反应 | 能溶于碱溶液 | 能溶于碱溶液 |
D.与某些氧化物反应 | 能与Fe2O3、MnO2、C如O3等金属氧化物发生铝热反应 | 能在CO2中燃烧 |

-
(1) SO2与Fe3+反应的还原、氧化产物分别是、(填离子符号).
-
(2) 下列实验方案可以用于在实验室制取所需SO2的是 .A . Na2SO3溶液与HNO3 B . Na2SO3固体与浓硫酸 C . 固体硫在纯氧中燃烧 D . 铜与热浓H2SO4
-
(3) 装置C的作用是.
-
(4) 如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为mol/L才能达到目的.
-
(5) 在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀.
上述方案不合理的是,原因是.
-
(6) 能表明I﹣的还原性弱于SO2的现象是,写出有关离子方程式:.
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
 B . 证明二氧化氮生成四氧化二氮为放热反应
B . 证明二氧化氮生成四氧化二氮为放热反应  C . 测定溶液pH
C . 测定溶液pH  D . 测定盐酸浓度
D . 测定盐酸浓度 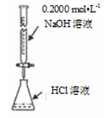

讨论回答下列问题:
-
(1) ①中加盐酸后的沉淀主要是(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有(一种即可)。
-
(2) 写出②、③中可能发生反应的离子方程式。
②、、、。
③、。
-
(3) 步骤②中不用氨水沉淀Fe3+的原因:。
 +Fe3++5OH-=2NH3·H2O+Fe(OH)3↓
B . 用稀氢碘酸除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C . 泡沫灭火器使用时发生的反应:Al3++3HCO
+Fe3++5OH-=2NH3·H2O+Fe(OH)3↓
B . 用稀氢碘酸除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C . 泡沫灭火器使用时发生的反应:Al3++3HCO  =Al(OH)3↓+3CO2↑
D . 向饱和碳酸钠溶液中通入过量的二氧化碳气体:CO
=Al(OH)3↓+3CO2↑
D . 向饱和碳酸钠溶液中通入过量的二氧化碳气体:CO  +CO2+ H2O=2HCO
+CO2+ H2O=2HCO 
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块用砂纸打磨过的铝条放入试管,再加入98.3%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
| B | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,试管口处湿润的红色石蕊试纸未变蓝 | 该盐中不含NH |
| C | 室温下,向 FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将浓盐酸加入到浓硫酸中,用来实验室快速制HCl气体 | 该实验体现了高沸点酸制取低沸点酸的原理 |
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12。
下列说法正确的是( )
 %
C . 硝基苯的作用为防止沉淀被氧化
D . 若取消步骤Ⅲ,测定结果偏大
%
C . 硝基苯的作用为防止沉淀被氧化
D . 若取消步骤Ⅲ,测定结果偏大
已知:25℃时NaClO溶液中HClO、 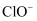 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。

-
(1) 工业上将Cl2通入
 的NaOH溶液中制备NaClO。
的NaOH溶液中制备NaClO。 ①该反应的离子方程式为;
②当溶液
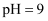 时,该溶液中主要存在的阴离子有(填化学式);
时,该溶液中主要存在的阴离子有(填化学式);③25℃时,反应
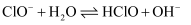 的平衡常数K=(填数值)。
的平衡常数K=(填数值)。 -
(2) 工业常用石灰乳和
 反应制取漂白粉,反应放热,温度过高时会发生副反应生成
反应制取漂白粉,反应放热,温度过高时会发生副反应生成  。反应过程中缓缓通入Cl2的目的是。
。反应过程中缓缓通入Cl2的目的是。
-
(3) 实验室将Cl2通入含水8%的
 固体中可制备Cl2O,生成的气体仅为Cl2O,该反应的化学方程式为。
固体中可制备Cl2O,生成的气体仅为Cl2O,该反应的化学方程式为。

-
(1) Ⅰ.NaClO的制备:
该学习小组按如图装置进行实验(部分夹持装置已省去),反应一段时间后,测得C中溶液的
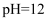 ;已知:饱和NaClO溶液pH为11。
;已知:饱和NaClO溶液pH为11。仪器a的名称为,装置A中发生反应的离子方程式为。
-
(2) C瓶溶液中c(ClO-)+c(Cl-)c(Na+) (填“>”、“<”或“=”)。
-
(3) 装置B的作用为。
-
(4) Ⅱ.测定NaCl的浓度:
取C瓶溶液20.00mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应:
 。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为,重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知:
。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为,重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知:  )。计算C瓶溶液中NaClO的物质的量浓度为mol/L。
)。计算C瓶溶液中NaClO的物质的量浓度为mol/L。 -
(5) 若滴定结束时俯视滴定管读数,则测定的NaClO的物质的量浓度将(填“偏高”、“偏低”或“无影响”)。




