实验4-2 金属镁、铝、锌化学性质的探究 知识点题库
铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 .(填序号)
A.生成氯化铝溶于水,而生成硫酸铝不溶于水
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
(2)铝片表面出现的暗红色物质是 .
(3)放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的其中一种原因是 .
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 .
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
A | 负极 | NaOH | 2Al﹣6e﹣+8OH﹣=2AlO2﹣+4H2O | 6H2O+6e﹣=6OH﹣+3H2↑ |
B | 负极 | 稀盐酸 | 2Al﹣6e﹣=2Al3+ | 6H++6e﹣=3H2↑ |
C | 正极 | 浓硝酸 | Mg﹣2e﹣=Mg2+ | 2NO3﹣+4H++4e﹣=2NO2↑+2H2O |
其中正确的是 (填序号),由此推知,金属作电极不仅与本身性质相关,而且与 有关.


溶液 | 加入物质 | 对应的图象 |
⑴饱和石灰水 | 通过量CO2气体 | |
⑵氯化铝溶液 | 加入过量氨水 | |
⑶MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | |
⑷含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
 B .
B .  C .
C .  D .
D . 
-
(1) H2O2的电子式
-
(2) 镁燃烧不能用CO2灭火,用化学方程式表示其理由。
-
(3) 二氧化锰与浓盐酸制氯气的离子方程式
-
(1) 铝原子核外有种不同运动状态的电子,最外层电子的轨道表示式为。
-
(2) 铍与铝性质相似。将BeCl2溶液加热蒸干后灼烧,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的分子式为。写出BeCl2溶液和过量氨水反应的离子方程式:。
-
(3) 取适量Al-Mg合金样品置于烧杯中,加入20mL1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是。
a.上述反应可视为原电池反应,此时Mg作负极,Al作正极
b.若加入的是20mL1mol/L的盐酸,则放出的氢气的物质的量减少

c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
-
(4) 用铝和金属氧化物反应制备单质是工业上较常用的方法。如:2Al+4BaO
 3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。
3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。 a.高温时,Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时,BaO∙Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
-
(5) 氮化铝是一种既有前途的电子绝缘基片材料,它化学稳定性好,耐高温、酸、碱,抗冲击能力强。可通过下列反应制备:Al2O3+3C+N2→2AlN+3CO+Q(Q<0)。上述反应物与生成物中,属于非极性分子的电子式为;构成AlN的微粒是。
-
(6) 下列选项能判断氮、氧元素非金属性强弱的是。
a.气态氢化物的沸点
b.单质与氢气化合的难易程度
c.最高价氧化物对应水化物的酸性
d.NO中O显-2价,N显+2价
-
(1) Ⅰ.元素铬(
 )在溶液中主要以
)在溶液中主要以 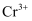 (蓝紫色)、
(蓝紫色)、  (绿色)、
(绿色)、  (橙红色)、
(橙红色)、  (黄色)等形式存在,
(黄色)等形式存在,  为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题: 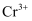 与
与  的化学性质相似,在
的化学性质相似,在 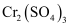 溶液中逐滴加入
溶液中逐滴加入  溶液直至过量,可观察到的现象是。
溶液直至过量,可观察到的现象是。 -
(2) +6价铬的化合物毒性较大,常用
 将废液中的
将废液中的  还原成
还原成 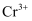 ,反应的离子方程式为。
,反应的离子方程式为。
-
(3) “酒后驾驶,害人害己”交警查酒驾的检测仪器中用到重铬酸钾(
 ),请简述该仪器涉及的化学原理。(用文字描述即可)
),请简述该仪器涉及的化学原理。(用文字描述即可)
-
(4) Ⅱ.无水氯化铝是白色晶体,易吸收水分,在178℃升华,无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融
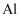 作用而制得,某课外活动小组在实验室内通过下列装置(如图)制取少量纯净的无水氯化铝。
作用而制得,某课外活动小组在实验室内通过下列装置(如图)制取少量纯净的无水氯化铝。 
试回答以下问题:
装置A中反应的化学方程式。
-
(5) 为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。如果A产生的气体直接进入B中,实验产生的不良后果是。
-
(6) 进行实验时,应先点燃(填写字母,下同)处的酒精灯,然后再点燃处的酒精灯。
-
(7) 在C处可以收集到纯净的氯化铝,原因是。
-
(8) 装置D的作用是。
 和少量
和少量  、
、  杂质)为原料制取铵明矾晶体
杂质)为原料制取铵明矾晶体  的一种工艺流程。
的一种工艺流程。 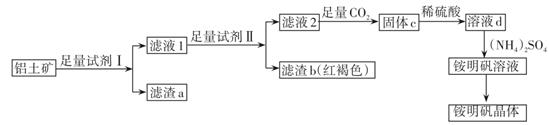
请回答:
-
(1) 试剂Ⅰ为,滤渣a可以“变废为宝”,写出它的一种用途。
-
(2) 证明铁元素已除尽的实验方法是。
-
(3) 滤液2中通入足量
 进行酸化得到固体c,则生成固体c的离子方程式为。
进行酸化得到固体c,则生成固体c的离子方程式为。
-
(4) 由溶液d制取铵明矾溶液的化学方程式为,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、、、干燥(填操作名称)。
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用坩埚钳夹持一片未打磨的薄铝片,在酒精灯火焰上加热, | 铝不能滴落下来,好像有一层膜兜着 | 铝熔点高,没能熔化 |
| B | 将H2在充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
| C | 取两支试管,分别放入一小片打磨过的铝片,再分别加入3mL20%的盐酸和氢氧化钠溶液 | 都有气体产生 | 前者生成氢气,后者生成氧气 |
| D | 相同温度条件下,向两支试管中分别加入2mL质量分数为3%和6%的H2O2溶液,再分别加入等量二氧化锰粉末,比较H2O2的分解速率 | 6%的H2O2溶液试管中产生气泡的速率较快 | 相同条件浓度大H2O2分解速率快 |
-
(1) Ⅰ 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。请根据题意回答以下问题:

海底埋藏着大量可燃烧的“冰”,“可燃冰”外观像冰,主要成分为甲烷水合物,并含有少量CO2等。可燃冰属于(填“纯净物”或“混合物”);在较低的温度和压力下,用甲烷为原料可制成金刚石薄膜,该变化属于(填“物理变化”或“化学变化”)。
-
(2) 铝制品表面因有一层氧化铝薄膜而经久耐用,若用铝制容器长期盛装含强碱性的食物该容器表面会发生破损,相关反应的离子方程式为。
-
(3) 粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序是。
-
(4) II 新型纳米材料氧缺位铁酸盐(MFe2Ox , 3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的。
ZnFe2O4中Fe元素的化合价为。
-
(5) 含氧铁盐K2FeO4的重要应用之一是生成Fe(OH)3胶体吸附净水。实验室可用饱和FeCl3溶液模拟该胶体的制备,请写出化学反应方程式。
-
(6) 在酸性条件下,某反应体系中共存在下列6种粒子:
 、Fe2+、H+、H2O、Cu2O、Cu2+ , 请完成该反应的离子方程式并用双线桥表示电子的转移。
、Fe2+、H+、H2O、Cu2O、Cu2+ , 请完成该反应的离子方程式并用双线桥表示电子的转移。



