实验4-2 金属镁、铝、锌化学性质的探究 知识点题库
将2.4g合金投入足量的稀硫酸中放出2.24L气体(标准状况),该合金可能是( )
A . 镁铝合金
B . 铝锌合金
C . 铁锌合金
D . 硅铁合金
下列有关说法中不正确的是( )
A . 铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同
B . 分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物
C . 等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多
D . 常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上
下列有关物质的性质或应用均正确的是( )
A . Si是一种非金属主族元素,其氧化物可用于制作计算机芯片
B . 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C . 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水
D . 用二氧化硫加工银耳,使之更白
化学与生活息息相关,请安要求回答下列生活中的化学问题:
-
(1) 工业上生产玻璃、水泥都要用到的原料是.
-
(2) 工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式).
-
(3) 酸雨有很大的危害,能直接破坏农作物,使土壤酸化.形成酸雨的原因之一是燃煤中产生了气体(填化学式).
-
(4) 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,写出过氧化钠与二氧化碳的化学反应方程式.
-
(5) 小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,写出胃舒平(主要成分为氢氧化铝)与胃酸(主要成分为稀盐酸)作用的离子方程式.
在1L0.1molNaAlO2和0.1mol Ba(NO3)2 的混合溶液中,逐滴加入浓度为0.1mol/L 的H2SO4 溶液,下列图象中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2﹣和Ba2+可以大量共存)( )
A .  B .
B .  C .
C . 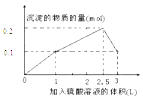 D .
D . 
 B .
B .  C .
C .  D .
D . 
下列物质间的反应肯定无明显实验现象的是( )
A . 加热经SO2漂白的品红试液
B . 将少量SO2通入NaOH溶液中
C . 将新制的氯水在阳光下照射
D . 将打磨的铝片加入浓NaOH溶液中一段时间
以氧化铝为原料制取氢氧化铝,最好的方法是( )
A . 将氧化铝溶于水
B . 将氧化铝先溶于盐酸中,之后滴加氨水
C . 将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D . 将氧化铝溶于氢氧化钾
含 MgCl2、AlCl3 均为 n mol 的混合溶液,向其中滴 NaOH 溶液至过量。加入 NaOH 的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀 pH 见表)( )
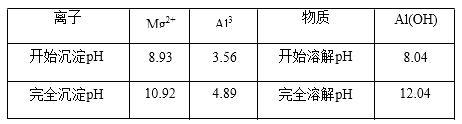
A .  B .
B . 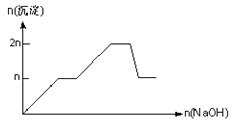 C .
C . 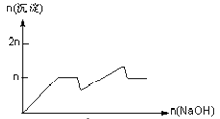 D .
D . 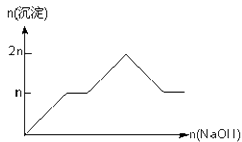
 B .
B .  C .
C .  D .
D . 
下列有关物质的性质与用途具有对应关系的是( )
A . ClO2具有强氧化性,可用于消毒杀菌
B . 浓硫酸具有脱水性,可用于干燥气体
C . 铝具有良好导热性,可用铝罐贮运浓硝酸
D . FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向Fe(OH)3胶体中逐滴加入稀硫酸至过量;④向AlCl3溶液中通入NH3气体至过量
A . ①②
B . ①③
C . ①④
D . ②③
除去括号内的杂质,选用的试剂不正确的是( )
A . CO2(HCl):饱和 NaHCO3溶液
B . FeCl2溶液(FeCl3):铁粉
C . CuO(Al2O3):NaOH溶液
D . NaOH溶液( Na2CO3):盐酸
下列有关物质的性质与用途具有对应关系的是( )
A . Al具有导电性,可用于防锈涂料制造
B . NH3具有碱性,可用于生产NH4HCO3
C . Na2O2呈淡黄色,可用于呼吸面具供氧
D . FeCl3易水解,可用于蚀刻铜制线路板
下列有关物质应用的说法中,错误的是( )
A . Na2CO3是发酵粉的主要成分之一
B . MgO常用作耐高温材料
C . 碘化银可用于人工降雨
D . 氯气可用于自来水消毒
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
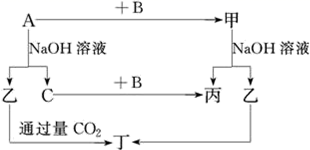
根据图示转化关系回答:
-
(1) 写出下列物质的化学式。
A,B,乙,丁。
-
(2) 写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式。
②甲与NaOH溶液反应的离子方程式。
2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
-
(1) ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的倍.
-
(2) 某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
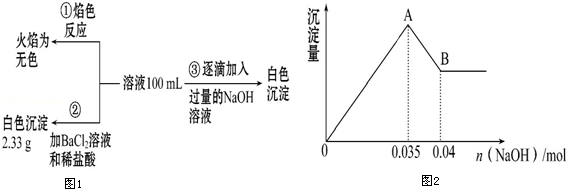
请根据上图回答下列问题:
①实验中需配制1.0mol•L﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为.
③试确定NO3-是否存在?(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=(若不存在,此问不必作答).
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释错误的是( )
A . 铝在空气中能很快形成氧化膜
B . 铝箔表面温度低,未熔化
C . 氧化铝的熔点比铝高
D . 氧化铝薄膜包住了熔化的铝
下列说法错误的是( )
A . 电解MgCl2溶液,可能生成Mg(OH)Cl沉淀
B . 碘单质与KOH溶液反应可得到补碘剂KIO3
C . 饱和碳酸钠溶液中通入足量CO2 , 可得到NaHCO3晶体
D . SO2还原FeSO4溶液生成Fe2(SO4)3溶液
下列现象或事实可用同一原理解释的是( )
A . 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B . 铁在冷的浓硫酸中和铝在冷的浓硫酸中都没有明显变化
C . SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D . 漂白粉和亚硫酸钠长期暴露在空气中变质
-
(1) I.A,B,C,D是中学化学的常见物质。已知:①A为黄绿色气体,B为金属单质;②A与B化合生成C,C的水溶液遇KSCN溶液呈红色;③D是第三周期的金属单质,能与盐酸、氢氧化钠溶液反应产生氢气,请回答:
C的化学式为; -
(2) 写出D与氢氧化钠溶液反应的化学方程式是;
-
(3) B与C的水溶液反应的离子方程式为。
-
(4) A可用于制取漂白粉,漂白粉的有效成分是(填化学式)。
-
(5) Ⅱ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
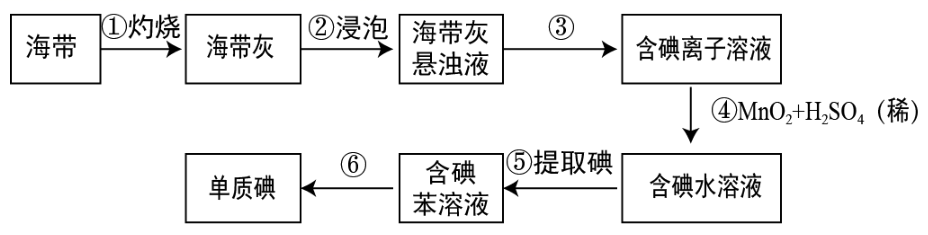
请填写下列空白:
步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____(从下列仪器中选出所需的仪器,用标号字母填写在空自处)。
A . 烧杯 B . 坩埚 C . 表面皿 D . 泥三角 E . 酒精灯 F . 干燥器 -
(6) 步骤③的实验操作名称是。
-
(7) 步骤④中还可以用
 , 请写出
, 请写出 氧化
氧化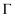 的离子方程式:。
的离子方程式:。
-
(8) 检验水溶液中是否含有单质碘可以用溶液。
下列方案设计、现象和结论都正确的是( )
目的 | 方案设计 | 现象和结论 | |
A | 检验溶液中是否含有 | 取少量该溶液于试管中,先滴加 | 若沉淀不溶解,则说明溶液中含有 |
B | 探究淀粉水解程度 | 在试管中加入2mL淀粉溶液和适量稀硫酸,加热 | 若溶液中没有出现砖红色沉淀,则说明淀粉未水解 |
C | 验证乙醇脱水生成乙烯 | 向无水乙醇中加入浓硫酸,加热至170℃,将产生的气体通入溴水中 | 若溴水褪色,则有乙烯生成 |
D | 比较金属铝和氧化铝熔点的高低 | 用坩埚夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 铝箔熔化但不滴落,说明金属铝的熔点比氧化铝低 |
A . A
B . B
C . C
D . D
最近更新

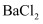 溶液,再加入稀盐酸
溶液,再加入稀盐酸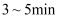 , 冷却后加入新制
, 冷却后加入新制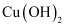 悬浊液加热煮沸
悬浊液加热煮沸


