е®һйӘҢ4-2 йҮ‘еұһй•ҒгҖҒй“қгҖҒй”ҢеҢ–еӯҰжҖ§иҙЁзҡ„жҺўз©¶ зҹҘиҜҶзӮ№йўҳеә“
й“қзҹҫзҹі(дё»иҰҒжҲҗеҲҶжҳҜAl2O3 пјҢ иҝҳеҗ«жңүе°‘йҮҸжқӮиҙЁSiO2гҖҒFe2O3)жҳҜе·ҘдёҡдёҠз”ЁдәҺзӮјй“қзҡ„дё»иҰҒзҹҝзү©д№ӢдёҖпјҢз”ұй“қзҹҫзҹіеҲ¶еҸ–йҮ‘еұһй“қзҡ„е·ҘиүәжөҒзЁӢеӣҫеҰӮдёӢпјҡ
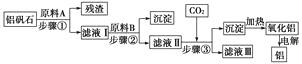
иҜ·еӣһзӯ”дёӢеҲ—жңүе…ій—®йўҳпјҡ

иҜ·еӣһзӯ”дёӢеҲ—жңүе…ій—®йўҳпјҡ
-
пјҲ1пјү дёӢеҲ—жңүе…ій“қзҹҫзҹід»ҘеҸҠз”Ёй“қзҹҫзҹізӮјй“қзҡ„иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјүA . й“қзҹҫзҹідёӯеҸӘеҗ«жңүйҮ‘еұһж°§еҢ–зү© B . й“қзҹҫзҹідёҺжІіжІҷеҗ«жңүзӣёеҗҢзҡ„жҲҗеҲҶ C . й“қзҹҫзҹізӮјй“қйңҖиҰҒж¶ҲиҖ—з”өиғҪ D . й“қзҹҫзҹізӮјй“қзҡ„иҝҮзЁӢдёӯдёҚж¶үеҸҠзҪ®жҚўеҸҚеә”
-
пјҲ2пјү еҺҹж–ҷAзҡ„еҗҚз§°жҳҜпјҢжӯҘйӘӨв‘ з”ЁеҲ°зҡ„дё»иҰҒзҺ»з’ғд»ӘеҷЁжңүгҖӮ
-
пјҲ3пјү ж»Өж¶Ів… дёӯиҰҒеҠ е…ҘзЁҚиҝҮйҮҸзҡ„еҺҹж–ҷBпјҢеҺҹж–ҷBзҡ„еҢ–еӯҰејҸжҳҜпјҢжӯҘйӘӨв‘ЎеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
-
пјҲ4пјү еңЁжӯҘйӘӨв‘ўдёӯ(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)з”Ёзӣҗй…ёд»ЈжӣҝCO2 пјҢ еҺҹеӣ жҳҜгҖӮ
дёӢеҲ—зү©иҙЁи·ҹзӣҗй…ёдёҚиғҪеҸ‘з”ҹеҸҚеә”зҡ„жҳҜпјҲВ пјү
A . зўұејҸзўій…ёй“ң
B . зЎ«й…ёж°ўй’
C . зўій…ёй’
D . еҸҢзҫҹеҹәй“қзўій…ёй’
еҸҚеә”2Al+Fe2O3  Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү
Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү
 Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү
Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү
A . еҢ–еҗҲеҸҚеә”
B . еӨҚеҲҶи§ЈеҸҚеә”
C . зҪ®жҚўеҸҚеә”
D . еҲҶи§ЈеҸҚеә”
ж №жҚ®й—®йўҳеЎ«з©әпјҡ
-
пјҲ1пјү жҠҠеҜ№еә”зү©иҙЁзҡ„еӯ—жҜҚд»Јз ҒеЎ«е…ҘжӢ¬еҸ·еҶ…пјҺ
AпјҺж°ҙзҺ»з’ғВ В В В В BпјҺжҳҺзҹҫВ В В В В В В В CпјҺжө“зЎ«й…ёDпјҺиҝҮж°§еҢ–й’ EпјҺж–°еҲ¶ж°Ҝж°ҙВ В В В В FпјҺе°ҸиӢҸжү“В В В В GпјҺдәҢзЎ«еҢ–зўіHпјҺж¬Ўж°Ҝй…ёй’ҷ
в‘ иғҪдҪҝзҹіи•ҠиҜ•ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІ
в‘ЎиғҪеҒҡжңЁжқҗйҳІзҒ«еүӮ
в‘ўиғҪеҒҡеӨ„зҗҶиғғй…ёиҝҮеӨҡзҡ„дёҖз§ҚиҚҜеүӮ
в‘ЈиғҪдҪңдёәеӨ„зҗҶиҜ•з®ЎеҶ…еЈҒжІҫжңүзЎ«зЈәзҡ„дёҖз§ҚиҜ•еүӮ
-
пјҲ2пјү з»ҝиүІеҢ–еӯҰиҰҒжұӮз»јеҗҲиҖғиҷ‘з»ҸжөҺгҖҒжҠҖжңҜгҖҒзҺҜдҝқзӯүж–№йқўжқҘи®ҫи®ЎеҢ–еӯҰеҸҚеә”и·ҜзәҝпјҺзҺ°д»Ҙй“ңдёәеҺҹж–ҷеҲ¶еҸ–зЎ«й…ёй“ңпјҢд»ҘдёӢеӣҫдёәдҫӢи®ҫи®Ўз¬ҰеҗҲз»ҝиүІеҢ–еӯҰжҖқжғізҡ„еҸҚеә”и·ҜзәҝпјҺAl
 AlCl3
AlCl3 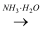 AlпјҲOHпјү3пјҺ
AlпјҲOHпјү3пјҺ
дёәдәҶйҷӨеҺ»й“ҒзІүдёӯзҡ„е°‘йҮҸй“қзІүпјҢеҸҜд»ҘйҖүеҸ–дёӢеҲ—е“Әз§Қжә¶ж¶ІпјҲгҖҖгҖҖпјү
A . жө“зӣҗй…ё
B . жө“зЎқй…ё
C . жө“зЎ«й…ё
D . жө“ж°ўж°§еҢ–й’ жә¶ж¶І
з”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒгҖҒжҲҠзҡ„зӣёдә’иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨәпјҲеҸҚеә”жқЎд»¶з•ҘеҺ»пјҢз®ӯеӨҙиЎЁзӨәдёҖжӯҘиҪ¬еҢ–пјүпјҺдёӢеҲ—еҗ„з»„зү©иҙЁдёӯпјҢж»Ўи¶іеҰӮеӣҫжүҖзӨәиҪ¬еҢ–е…ізі»зҡ„жҳҜпјҲгҖҖгҖҖпјү
з”І | д№ҷ | дёҷ | жҲҠ | |
A | Na2O2 | CO2 | O2 | Na |
B | Fe | H2O | Fe2O3 | H2 |
C | MgO | зӣҗй…ё | MgCl2 | NaOH |
D | CuSO4 | Zn | Cu | зЁҖH2SO4 |
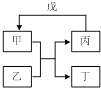
A . A
B . B
C . C
D . D
еҗ‘MgSO4е’ҢAl2пјҲSO4пјү3зҡ„ж··еҗҲжә¶ж¶ІдёӯпјҢйҖҗж»ҙеҠ е…ҘNaOHжә¶ж¶ІпјҺдёӢеҲ—еӣҫиұЎдёӯпјҢиғҪжӯЈзЎ®иЎЁзӨәдёҠиҝ°еҸҚеә”зҡ„жҳҜпјҲжЁӘеқҗж ҮиЎЁзӨәеҠ е…ҘNaOHжә¶ж¶Ізҡ„дҪ“з§ҜпјҢзәөеқҗж ҮиЎЁзӨәеҸҚеә”з”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸпјүпјҲ пјү
A .  B .
B . 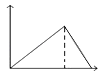 C .
C .  D .
D . 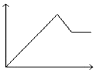
 B .
B .  C .
C .  D .
D . 
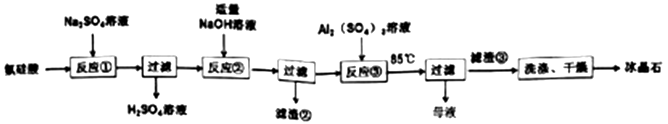
з”Ёж°ҹзЎ…й…ё(H2SiF6)еҲ¶еӨҮеҶ°жҷ¶зҹі(Na3AlF6)зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢжүҖзӨәпјҡ
-
пјҲ1пјү ж°ҹзЎ…й…ё(H2SiF6)й…ёжҖ§ејәдәҺзЎ«й…ёпјҢйҖҡеёёз”ұеӣӣж°ҹеҢ–зЎ…з»Ҹж°ҙеҗёж”¶еҲ¶еҫ—пјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү еҸҚеә”в‘Ўдёәи„ұзЎ…е·ҘиүәпјҢж»ӨжёЈв‘ЎжҳҜгҖӮ
-
пјҲ3пјү еҗ‘NaFжә¶ж¶ІдёӯеҠ е…ҘAl2(SO4)3жә¶ж¶ІеҸ‘з”ҹеҸҚеә”в‘ўзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјӣNaFжә¶ж¶Іе‘ҲзўұжҖ§пјҢеңЁеҠ е…ҘAl2(SO4)3жә¶ж¶ІеүҚпјҢйңҖе…Ҳз”ЁзЎ«й…ёе°ҶNaFжә¶ж¶Ізҡ„pHдёӢи°ғиҮі5е·ҰеҸіпјҢеҗҰеҲҷеҸҜиғҪдә§з”ҹеүҜдә§зү©гҖӮ
-
пјҲ4пјү е№ІзҮҘеүҚпјҢжЈҖйӘҢеҶ°жҷ¶зҹіжҳҜеҗҰжҙ—ж¶Өе№ІеҮҖзҡ„е®һйӘҢж–№жі•жҳҜгҖӮ
-
пјҲ5пјү д»ҺжҜҚж¶ІдёӯеҸҜеҫӘзҺҜеҲ©з”Ёзҡ„зү©иҙЁжҳҜгҖӮ
-
пјҲ6пјү зўій…ёеҢ–жі•д№ҹжҳҜе·ҘдёҡеҲ¶еҸ–еҶ°жҷ¶зҹізҡ„дёҖз§Қж–№жі•пјҡеңЁеҒҸй“қй…ёй’ еҸҠж°ҹеҢ–й’ жә¶ж¶ІдёӯпјҢйҖҡе…Ҙи¶ійҮҸдәҢж°§еҢ–зўіеҚіеҸҜпјҢиҜ·еҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
дёӢеҲ—е®һйӘҢзҺ°иұЎжҸҸиҝ°й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . дәҢж°§еҢ–зўіж°”дҪ“йҖҡе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢжә¶ж¶ІеҸҳзәўиүІ
B . й•ҒжқЎеңЁз©әж°”йҮҢзҮғзғ§пјҢеҸ‘еҮәиҖҖзңјзҡ„зҷҪе…үпјҢж”ҫзғӯпјҢдә§з”ҹзҷҪзғҹпјҢз”ҹжҲҗзҷҪиүІзІүжң«зҠ¶еӣәдҪ“
C . й“қдёҺзЎқй…ёй“ңжә¶ж¶ІеҸҚеә”银зҷҪиүІеӣәдҪ“иЎЁйқўжңүзҙ«зәўиүІзү©иҙЁз”ҹжҲҗпјҢж”ҫзғӯпјҢжә¶ж¶Із”ұи“қиүІеҸҳдёәж— иүІ
D . иӮҘзҡӮж°ҙж»ҙе…ҘзЎ¬ж°ҙдёӯпјҢдә§з”ҹиҫғеӨҡзҡ„жіЎжІ«пјҢжңүжө®жёЈ
й“қе…·жңүиҫғејәзҡ„жҠ—и…җиҡҖиғҪеҠӣпјҲеҚіиҖҗи…җиҡҖпјүзҡ„дё»иҰҒеҺҹеӣ жҳҜпјҲпјү
A . й“қеҢ–еӯҰжҖ§иҙЁеҫҲзЁіе®ҡпјҲеҚіеҫҲдёҚжҙ»жіјпјү
B . й“қдёҺж°§ж°”еңЁеёёжё©дёӢеҫҲйҡҫеҸҚеә”
C . й“қжҳҜдёӨжҖ§е…ғзҙ пјҲеӣ дёҺй…ёгҖҒзўұйғҪиғҪеҸҚеә”пјү
D . й“қжҳ“ж°§еҢ–еҪўжҲҗдёҖеұӮиҮҙеҜҶж°§еҢ–иҶң
дёӢеҲ—е…ідәҺе…ғзҙ еҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
A . иҝҮж°§еҢ–й’ ж”ҫзҪ®еңЁз©әж°”дёӯпјҢжңҖз»ҲиҪ¬еҸҳдёәзҷҪиүІзІүжң«Na2CO3
B . Ca(ClO)2жә¶ж¶ІйҖҡе…ҘCO2 пјҢ жә¶ж¶ІеҸҳжө‘жөҠпјӣеҶҚеҠ е…Ҙе“Ғзәўжә¶ж¶ІпјҢзәўиүІиӨӘеҺ»
C . жү“зЈЁиҝҮзҡ„й“қз®”е’ҢжңӘжү“зЈЁзҡ„й“қз®”еҲҶеҲ«еңЁз©әж°”дёӯзҒјзғ§пјҢдёӨз§Қй“қз®”еқҮзҶ”еҢ–дҪҶдёҚж»ҙиҗҪпјҢиҜҙжҳҺж°§еҢ–й“қзҶ”зӮ№жҜ”й“қй«ҳ
D . еңЁдёҖе®ҡжқЎд»¶дёӢпјҢйҮ‘еұһNaгҖҒMgгҖҒFeдёҺж°ҙеҸҚеә”йғҪз”ҹжҲҗH2е’ҢеҜ№еә”зҡ„зўұ
дёӢеҲ—еҗ„з»„зү©иҙЁпјҢж— и®әжҳҜеүҚиҖ…ж»ҙе…ҘеҗҺиҖ…пјҢиҝҳжҳҜеҗҺиҖ…ж»ҙе…ҘеүҚиҖ…пјҢеҸҚеә”зҺ°иұЎйғҪзӣёеҗҢзҡ„жҳҜпјҲ пјү
A . AlCl3е’ҢNaOH
B . H2SO4е’ҢBa(OH)2
C . NaAlO2е’ҢH2SO4
D . Na2CO3е’ҢHCl
зӯүзү©иҙЁзҡ„йҮҸзҡ„Naе’ҢAlдёӨз§ҚйҮ‘еұһеҠ е…Ҙи¶ійҮҸзҡ„ж°ҙдёӯпјҢз”ҹжҲҗ26.88LпјҲж ҮеҮҶзҠ¶еҶөдёӢпјүзҡ„ж°”дҪ“пјҢеҲҷдёӢеҲ—жҸҸиҝ°й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . йҮ‘еұһ Naж— еү©дҪҷ
B . йҮ‘еұһAlжңүеү©дҪҷ
C . жүҖеҫ—жә¶ж¶Іжә¶иҙЁдёәNaAlO2
D . Naзҡ„зү©иҙЁзҡ„йҮҸжҳҜ0.6mol
й•Ғй“қеҗҲйҮ‘гҖҒй“ҒеҗҲйҮ‘гҖҒзЎ…й…ёзӣҗйғҪжҳҜе№ҝжіӣзҡ„е»әзӯ‘жқҗж–ҷгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳ
-
пјҲ1пјү й“қзҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫдёәпјӣеңЁе‘ЁжңҹиЎЁдёӯ第周жңҹпјҢ第ж—Ҹпјӣй“қжҳҜдёҖз§Қжҙ»жіјзҡ„йҮ‘еұһпјҢдҪҶеңЁз©әж°”дёӯдёҚжҳ“иў«и…җиҡҖпјҢеҺҹеӣ жҳҜпјҲз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәпјүпјӣеҶҷеҮәй“қдёҺзғ§зўұеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ2пјү й’ўжҳҜз”ЁйҖ”жңҖе№ҝгҖҒз”ЁйҮҸжңҖеӨҡзҡ„й“ҒеҗҲйҮ‘пјҢжҹҗз§Қй’ўз”ұй“Ғе’ҢеҸҰдёҖз§Қе…ғзҙ з»„жҲҗпјҢе°Ҷе°‘йҮҸзҡ„й’ўж ·е“ҒдёҺи¶ійҮҸзғӯзҡ„жө“зЎ«й…ёе……еҲҶеҸҚеә”з”ҹжҲҗдёӨз§Қж°”дҪ“пјҢеҶҷеҮәз”ҹжҲҗдёӨз§Қж°”дҪ“зҡ„еҢ–еӯҰж–№зЁӢејҸпјӣз”Ёй•ҝж»ҙз®Ўеҗ‘зЎ«й…ёдәҡй“Ғжә¶ж¶Ідёӯж»ҙеҠ з…®жІёиҝҮзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜпјӣеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјӣгҖӮ
-
пјҲ3пјү ж»‘зҹізІүзҡ„дё»иҰҒжҲҗеҲҶжҳҜMg3[Si4O10](OH)2,з”Ёж°§еҢ–зү©иЎЁзӨәе…¶з»„жҲҗпјҡпјӣдәҢж°§еҢ–зЎ…иғҪдёҺдёҖз§Қй…ёеҸҚеә”пјҢеҸҜж №жҚ®жӯӨеҸҚеә”еҺҹзҗҶеҲ¶йӣ•иҠұзҺ»з’ғпјҢиҝҷз§Қй…ёжҳҜпјӣеёёз”Ёзҡ„зЎ…й…ёзӣҗдә§е“ҒжңүгҖҒ гҖҒгҖӮ
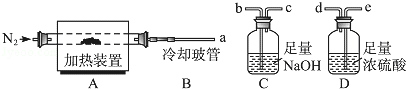
ж°ҜзҰ»еӯҗжҸ’еұӮй•Ғй“қж°ҙж»‘зҹі[Mg2AlпјҲOHпјү6ClвҖўxH2O]жҳҜдёҖз§Қж–°еһӢзҰ»еӯҗдәӨжҚўжқҗж–ҷпјҢе…¶еңЁй«ҳжё©дёӢе®Ңе…ЁеҲҶи§ЈдёәMgOгҖҒAl2O3гҖҒHClе’Ңж°ҙи’ёж°”пјҺзҺ°з”ЁеҰӮеӣҫиЈ…зҪ®иҝӣиЎҢе®һйӘҢзЎ®е®ҡе…¶еҢ–еӯҰејҸпјҲеӣәе®ҡиЈ…зҪ®з•ҘеҺ»пјүпјҺ
-
пјҲ1пјү Mg2AlпјҲOHпјү6ClвҖўxH2OзғӯеҲҶи§Јзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҺ
-
пјҲ2пјү иӢҘеҸӘйҖҡиҝҮжөӢе®ҡиЈ…зҪ®CгҖҒDзҡ„еўһйҮҚжқҘзЎ®е®ҡxпјҢеҲҷиЈ…зҪ®зҡ„иҝһжҺҘйЎәеәҸдёәпјҲжҢүж°”жөҒж–№еҗ‘пјҢз”ЁжҺҘеҸЈеӯ—жҜҚиЎЁзӨәпјүпјҢе…¶дёӯCзҡ„дҪңз”ЁжҳҜпјҺиЈ…зҪ®иҝһжҺҘеҗҺпјҢйҰ–е…ҲиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңзҡ„еҗҚз§°жҳҜпјҺ
-
пјҲ3пјү еҠ зғӯеүҚе…ҲйҖҡN2жҺ’е°ҪиЈ…зҪ®дёӯзҡ„з©әж°”пјҢз§°еҸ–CгҖҒDзҡ„еҲқе§ӢиҙЁйҮҸеҗҺпјҢеҶҚжҢҒз»ӯйҖҡе…ҘN2зҡ„дҪңз”ЁжҳҜгҖҒзӯүпјҺ
-
пјҲ4пјү е®Ңе…ЁеҲҶи§ЈеҗҺжөӢеҫ—CеўһйҮҚ3.65gгҖҒDеўһйҮҚ9.90gпјҢеҲҷx=пјҺиӢҘеҸ–ж¶ҲеҶ·еҚҙзҺ»з®ЎBеҗҺиҝӣиЎҢе®һйӘҢпјҢжөӢе®ҡзҡ„xеҖје°ҶпјҲеЎ«вҖңеҒҸй«ҳвҖқжҲ–вҖңеҒҸдҪҺвҖқпјүпјҺ
-
пјҲ5пјү дёҠиҝ°ж°ҙж»‘зҹіеңЁз©әж°”дёӯж”ҫзҪ®ж—¶жҳ“еҸ‘з”ҹеҸҚеә”з”ҹжҲҗ[Mg2AlпјҲOHпјү6Cl1п№Ј2xпјҲCO3пјүyвҖўzH2O]пјҢиҜҘз”ҹжҲҗзү©иғҪеҸ‘з”ҹзұ»дјјзҡ„зғӯеҲҶи§ЈеҸҚеә”пјҺзҺ°д»ҘжӯӨзү©иҙЁдёәж ·е“ҒпјҢз”ЁпјҲ2пјүдёӯиҝһжҺҘзҡ„иЈ…зҪ®е’ҢиҜ•еүӮиҝӣиЎҢе®һйӘҢжөӢе®ҡzпјҢйҷӨжөӢе®ҡDзҡ„еўһйҮҚеӨ–пјҢиҮіе°‘иҝҳйңҖжөӢе®ҡпјҺ
жңүе…ій“қеҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
A . й“Ғжҳ“з”ҹй”ҲпјҢиҖҢй“қеңЁз©әж°”дёӯиҫғзЁіе®ҡпјҢжүҖд»Ҙй“ҒжҜ”й“қжҙ»жіј
B . й“қеҲ¶е“ҒдёҚе®ңй•ҝж—¶й—ҙзӣӣж”ҫе’ёиҸңзӯүи…ҢеҲ¶йЈҹе“Ғ
C . ж°§еҢ–й“қжҳҜдёҖз§ҚиҫғеҘҪзҡ„иҖҗзҒ«жқҗж–ҷпјҢдҪҶдёҚеҸҜз”Ёж°§еҢ–й“қеқ©еҹҡзҶ”еҢ–NaOH
D . ж°ўж°§еҢ–й“қиғҪдёӯе’Ңиғғй…ёпјҢеҸҜз”ЁдәҺеҲ¶иғғиҚҜ
еңЁз»ҷе®ҡжқЎд»¶дёӢпјҢдёӢеҲ—йҖүйЎ№жүҖзӨәзҡ„зү©иҙЁй—ҙиҪ¬еҢ–еқҮиғҪе®һзҺ°зҡ„жҳҜвҖҒ( )
A . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
B . S
Mg
B . S  SO3
SO3  H2SO4
C . зІ—зЎ…
H2SO4
C . зІ—зЎ…  SiCl4
SiCl4  Si
D . Fe
Si
D . Fe  FeCl2
FeCl2  Fe(OH)2
Fe(OH)2
 MgCl2(aq)
MgCl2(aq)  Mg
B . S
Mg
B . S  SO3
SO3  H2SO4
C . зІ—зЎ…
H2SO4
C . зІ—зЎ…  SiCl4
SiCl4  Si
D . Fe
Si
D . Fe  FeCl2
FeCl2  Fe(OH)2
Fe(OH)2
еҢ—дә¬еҶ¬еҘҘдјҡзҒ«з§ҚзҒҜзҡ„еӨ–еҪўи®ҫи®ЎзҒөж„ҹжқҘиҮӘдәҺжІіеҢ—еҚҡзү©йҷўзҡ„вҖңй•ҝдҝЎе®«зҒҜвҖқгҖӮ

дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . йқ’й“ңзҡ„зЎ¬еәҰеӨ§дәҺзәҜй“ң
B . й•ҸйҮ‘еұӮз ҙжҚҹеҗҺз”ҹжҲҗй“ңй”Ҳзҡ„дё»иҰҒжҲҗеҲҶдёәCuO
C . й“қеҗҲйҮ‘иЎЁйқўж°§еҢ–зү©и–„иҶңеҸҜд»ҘдҝқжҠӨеҶ…йғЁйҮ‘еұһдёҚиў«и…җиҡҖ
D . дёӨзҒҜжүҖз”Ёзҡ„зҮғж–ҷе……еҲҶзҮғзғ§еҗҺзҡ„дә§зү©еқҮдёәCO2е’ҢH2O
й“қжҳҜең°еЈідёӯеҗ«йҮҸжңҖй«ҳзҡ„йҮ‘еұһе…ғзҙ пјҢдёӢеҲ—е…ідәҺй“қеҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . еҸҜз”ЁNaOHжә¶ж¶ІйҷӨеҺ»Fe2O3зІүжң«дёӯе°‘йҮҸзҡ„Al2O3
B . зәҜй“қзҡ„зЎ¬еәҰе’ҢејәеәҰиҫғе°ҸпјҢдёҚйҖӮеҗҲз”ЁдәҺеҲ¶йҖ жңәеҷЁйӣ¶д»¶
C . й“қеҲ¶е“Ғе»үд»·жҳ“еҫ—пјҢйҖӮз”ЁдәҺеҺЁжҲҝи’ёз…®е’Ңй•ҝжңҹеӯҳж”ҫзўұжҖ§йЈҹзү©
D . й“қеңЁеҶ·зҡ„жө“зЎқй…ёдёӯеҸ‘з”ҹй’қеҢ–пјҢеӣ жӯӨеҸҜз”Ёй“қж§ҪиҪҰиҝҗиҫ“жө“зЎқй…ё
вҖңзұ»жҜ”вҖқжҳҜеҢ–еӯҰеӯҰд№ дёӯдёҖз§Қеёёз”Ёзҡ„ж–№жі•пјҢдёӢеҲ—вҖңзұ»жҜ”вҖқз»“жһңжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . з©әж°”дёӯеҠ зғӯй’ еҚ•иҙЁеҫ—еҲ° пјҢ еҲҷеҠ зғӯй”ӮеҚ•иҙЁеҫ—еҲ°
пјҢ еҲҷеҠ зғӯй”ӮеҚ•иҙЁеҫ—еҲ° B .
B . 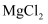 жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ
жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ пјҢ еҲҷ
пјҢ еҲҷ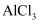 жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ
жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ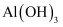 C .
C . 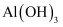 дёәдёӨжҖ§ж°ўж°§еҢ–зү©пјҢеҲҷ
дёәдёӨжҖ§ж°ўж°§еҢ–зү©пјҢеҲҷ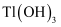 д№ҹдёәдёӨжҖ§ж°ўж°§еҢ–зү©
D .
д№ҹдёәдёӨжҖ§ж°ўж°§еҢ–зү©
D .  дёҺж°ҙеҸҚеә”з”ҹжҲҗHClе’ҢHClOпјҢжҺЁжөӢ
дёҺж°ҙеҸҚеә”з”ҹжҲҗHClе’ҢHClOпјҢжҺЁжөӢ дёҺж°ҙеҸҚеә”з”ҹжҲҗHFе’ҢHFO
дёҺж°ҙеҸҚеә”з”ҹжҲҗHFе’ҢHFO
 пјҢ еҲҷеҠ зғӯй”ӮеҚ•иҙЁеҫ—еҲ°
пјҢ еҲҷеҠ зғӯй”ӮеҚ•иҙЁеҫ—еҲ° B .
B . 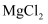 жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ
жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ пјҢ еҲҷ
пјҢ еҲҷ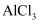 жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ
жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙз”ҹжҲҗ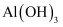 C .
C . 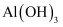 дёәдёӨжҖ§ж°ўж°§еҢ–зү©пјҢеҲҷ
дёәдёӨжҖ§ж°ўж°§еҢ–зү©пјҢеҲҷ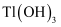 д№ҹдёәдёӨжҖ§ж°ўж°§еҢ–зү©
D .
д№ҹдёәдёӨжҖ§ж°ўж°§еҢ–зү©
D .  дёҺж°ҙеҸҚеә”з”ҹжҲҗHClе’ҢHClOпјҢжҺЁжөӢ
дёҺж°ҙеҸҚеә”з”ҹжҲҗHClе’ҢHClOпјҢжҺЁжөӢ дёҺж°ҙеҸҚеә”з”ҹжҲҗHFе’ҢHFO
дёҺж°ҙеҸҚеә”з”ҹжҲҗHFе’ҢHFO
жңҖиҝ‘жӣҙж–°



