第二单元 钠、镁及其化合物 知识点题库
处于下列状态的物质:A.氯化钠晶体 B.CO2 C.无水醋酸 D.铁E.BaSO4 F.熔融的氯化镁 G.酒精 H.氨水 (请用字母填写).
-
(1) 上述物质中能导电的是:
-
(2) 上述物质中属于电解质的是:
-
(3) 上述物质中属于非电解质的是:.
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图1(已知2KI+Cl2=2KCl+I2 , 碘与溴一样易溶于有机溶剂):
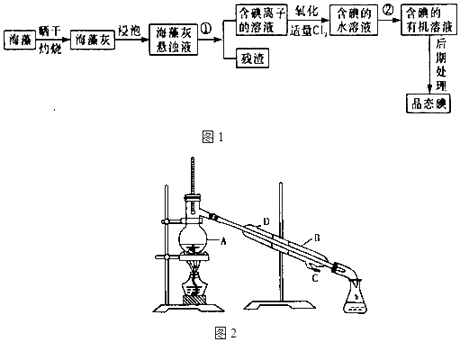
-
(1) 图2中A 仪器的名称是,仪器B中冷凝水的水流方向:.
-
(2) 提取碘的过程中,可供选择的有机试剂是 (填字母)A . 苯 B . 四氯化碳 C . 酒精 D . 醋酸.
某无色透明溶液中可能大量存在Ag+ , Mg2+ , Cu2+中的几种离子.
-
(1) 不做任何实验就可以肯定原溶液中不存在的离子是.
-
(2) 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是,有关的离子反应式为.
-
(3) 取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有.
-
(4) 原溶液中可能大量存在的阴离子是下列A﹣D中的(填序号) .A . Cl﹣ B . CO32﹣ C . NO3﹣ D . OH﹣ .
向以下六种饱和溶液中分别持续通入CO2 , 最终得到沉淀或析出晶体的一组是( )
①Ba(NO3)2②Ca(OH)2③Na2SiO3④Na[Al(OH)4]⑤Na2CO3⑥NH3和NaCl.
A . ①③④⑥
B . ②③④⑥
C . ③④⑤⑥
D . ①②③⑤
把河沙跟镁粉按一定质量比例混合均匀(15:24),装入试管中加热,大约1min发生剧烈反应,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,即产生气泡,并伴有爆鸣声,产生一种气态氢化物.
-
(1) 写出河沙跟镁粉在加热条件下反应的方程式,并标明是放热还是吸热:,.
-
(2) 写出生成的混合物放入稀硫酸中发生反应的方程式:.
-
(3) 写出产生“爆鸣声”的化学方程式:.
将少量钠投入盛有硫酸铜溶液的烧杯中,试写出能观察到的现象及产生这些现象的原因.
-
(1) ,;
-
(2) ,;
-
(3) ,
-
(4) ,.
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3﹣、Cl﹣、I﹣、MnO4﹣、SO42﹣等离子中的几种离子.为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断正确的是( )
A . 仅有实验①可推出肯定含有SO42﹣ , 不含Cl﹣
B . 该无色溶液肯定含有NH4+、K+、Al3+、SO42﹣
C . 该无色溶液中肯定不含K+、Mg2+、HCO3﹣、Cl﹣、MnO4﹣、I﹣
D . 不能确定该无色溶液是否含有K+
向物质的量浓度均为1mol/L的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,如图中[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是( )
A . 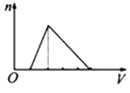 B .
B . 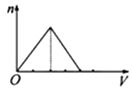 C .
C . 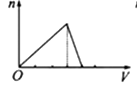 D .
D . 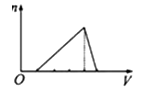
 B .
B .  C .
C .  D .
D . 
某溶液能与Al粉反应放出H2 , 该溶液中可能大量共存的离子组是( )
A . NH4+、Ba2+、HCO3-、Cl-
B . K+、Al3+、S2-、ClO-
C . Na+、Fe3+、Cl-、SO42-
D . H+、Mg2+、SO42-、NO3-
现有以下物质:①NaHSO4晶体 ②SO2 ③NaCl固体 ④盐酸溶液 ⑤蔗糖 ⑥铜 ⑦Ba(OH)2固体。请回答下列问题:
-
(1) 属于电解质的是(填序号);
-
(2) 属于非电解质的是(填序号);
-
(3) 属于电解质的依次写出其在水中的电离方程式。
下列说法正确的是( )
A . 用湿润的pH试纸测定NaCl 溶液的pH时会影响测定结果
B . 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C . 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D . 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
在溶液中一定能大量共存的离子组是( )
A . H+、Fe2+、Cl-、SO42-、NO3-
B . S2-、SO32-、Br-、Na+、OH-
C . ClO-、Na+、H+、NH4+、Cl-
D . Na+、Mg2+、Cl-、SO42-、OH-
Na2CO3是一种重要的化工原料,工业上生产Na2CO3的主要流程可表示如下:
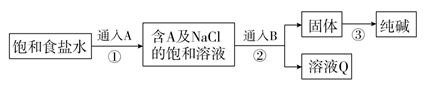
则下列说法中正确的是( )
A . A气体是CO2 , B是NH3
B . ③中生成的CO2可循环使用,它可完全满足生产的需要
C . 通入B后的离子方程式为Na++NH3+CO2+H2O=NaHCO3↓+NH4+
D . 溶液Q的成分是NH4Cl,可通过降温结晶的方法使其析出
下列物质中,属于电解质的是( )
A . Fe
B . NaCl
C . 稀盐酸
D . Na2SO4溶液
目前海水提溴的最主要方法之一是空气吹出法工艺,其流程图如下。下列说法错误的是( )
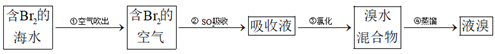
A . 热空气能吹出溴是利用溴易挥发的性质
B .  吸收溴的离子方程式为
吸收溴的离子方程式为  C . 不采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
D . 蒸馏操作用到的主要仪器有蒸馏烧瓶和分液漏斗
C . 不采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
D . 蒸馏操作用到的主要仪器有蒸馏烧瓶和分液漏斗
 吸收溴的离子方程式为
吸收溴的离子方程式为  C . 不采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
D . 蒸馏操作用到的主要仪器有蒸馏烧瓶和分液漏斗
C . 不采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
D . 蒸馏操作用到的主要仪器有蒸馏烧瓶和分液漏斗
下列变化中,只涉及物理变化的是( )
A . 盐酸除锈
B . 石油分馏
C . 海水提溴
D . 煤干馏
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . 使酚酞变红色的无色溶液中:  、Cl−、Cu2+
B . pH=2的溶液中:Ca2+、Cl−、
、Cl−、Cu2+
B . pH=2的溶液中:Ca2+、Cl−、  C . 含有大量Fe3+的溶液中:
C . 含有大量Fe3+的溶液中:  、S2−、SCN−
D . 水电离的c(H+)=1×10−13mol·L−1的溶液中:Na+ , Al3+、
、S2−、SCN−
D . 水电离的c(H+)=1×10−13mol·L−1的溶液中:Na+ , Al3+、 
 、Cl−、Cu2+
B . pH=2的溶液中:Ca2+、Cl−、
、Cl−、Cu2+
B . pH=2的溶液中:Ca2+、Cl−、  C . 含有大量Fe3+的溶液中:
C . 含有大量Fe3+的溶液中:  、S2−、SCN−
D . 水电离的c(H+)=1×10−13mol·L−1的溶液中:Na+ , Al3+、
、S2−、SCN−
D . 水电离的c(H+)=1×10−13mol·L−1的溶液中:Na+ , Al3+、 
食盐在工业上应用广泛。用电解饱和食盐水的方法生产氯气和烧碱:向已经氨化的饱和食盐水中通入CO2 , 会析出碳酸氢钠晶体,加热碳酸氢钠得到碳酸钠。
-
(1) 食盐溶于水发生电离,其电离方程式。
-
(2) 2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为(用化学方程式表示)。
-
(3) 事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是(结合化学方程式解释)。
-
(4) 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
①饱和食盐水中先通入NH3达饱和,再通入CO2至饱和,会析出碳酸氢钠晶体,写出该反应的化学方程式。将碳酸氢钠溶于水,溶液显性。(填“酸”、“碱”或“中”)。
②碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的化学方程式为。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者后者(填“>”、“<”或“=”)。
③除去碳酸钠固体中碳酸氢钠的反应的化学方程式为。
在澄清透明的溶液中,下列各组离子能大量共存的是( )
A . Fe3+、Na+、Cl-、SO  B . Na+、H+、Cl-、CO
B . Na+、H+、Cl-、CO  C . NH
C . NH  、K+、SO
、K+、SO  、OH-
D . Na+、Ba2+、CO
、OH-
D . Na+、Ba2+、CO  、NO
、NO 
 B . Na+、H+、Cl-、CO
B . Na+、H+、Cl-、CO  C . NH
C . NH  、K+、SO
、K+、SO  、OH-
D . Na+、Ba2+、CO
、OH-
D . Na+、Ba2+、CO  、NO
、NO 
钠露置在空气中,最终产物是( )
A . NaOH
B . Na2O2
C . Na2CO3
D . Na2CO3·10H2O
最近更新



