第二单元 钠、镁及其化合物 知识点题库
常温下,若溶液中由水电离产生的c(H+)、c(OH﹣)满足c(H+)•c(OH﹣)=10﹣24 , 则下列各组离子在该溶液中一定可以大量共存的是( )
A . Al3+、Na+、NO3﹣、Cl﹣
B . K+、Na+、Cl﹣、NO3﹣
C . K+、Na+、Cl﹣、AlO2﹣
D . K+、NH4+、SO42﹣、NO3﹣
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A . ①②③
B . ①③④
C . ②③
D . ①④
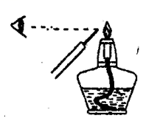
将一块铝箔用砂纸打磨表面后,在酒精灯上加热至熔化,下列说法正确的是:( )
A . 熔化的是铝
B . 熔化的是Al2O3
C . 熔化物迅速燃烧
D . 熔化物迅速滴落下来
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . 能使酚酞变红的溶液中:Na+、K+、SiO32-、CO32-
B . c(ClO-)=1mol·L-1的溶液中:H+、NH4+、Cl-、I-
C . c(H+)/c(OH-)=1×1012mol·L-1的溶液中:NH4+、Cu2+、SO42-、CH3COO-
D . 由水电离产生的c(H+)=1×10-13 mol·L-1的溶液中:Na+、Fe2+、SCN-、NO3-
25℃,对于1L1mol·L-1CuSO4溶液和1L1mol·L-1FeCl3溶液,下列说法正确的是()
A . 前者溶液为黄色,后者为蓝色
B . 加入1L1mol·L-1Na2CO3溶液后都能大量共存
C . 加入28g还原铁粉,都发生氧化还原反应
D . 都可以催化H2O2的分解,且催化效果相同
常温下设a代表Ba(OH)2 , b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是( )
A . 同物质的量浓度的三种溶液的pH:a=b>c
B . 同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C . 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D . 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
下列说法正确的是( )
A . 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B . 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C . 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D . 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生 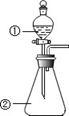

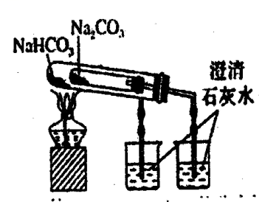
关于 Na2CO3 和 NaHCO3 性质的说法错误的是( )
A . 热稳定性:NaHCO3<Na2CO3
B . 与同浓度盐酸反应的剧烈程度:NaHCO3<Na 2CO3
C . 相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D . 等物质的量的 Na2CO3、NaHCO3 分别与足量盐酸反应产生的 CO2 质量相同
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
-
(1) 完成下列表格中实验①的结论和实验②的实验内容以及现象:、

-
(2) 根据(1)中的实验回答:
NO3-存在于溶液中,理由是;
Cl-存在于溶液中,理由是。
-
(3) 根据(1)中的实验确定,M溶液中含有的离子为
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W  X + H2O + CO2↑
X + H2O + CO2↑
②Z +CO2 → X + O2
③Z+H2O → Y + O2↑
④X + Ca(OH)2 → Y + CaCO3↓
试回答下列问题:
-
(1) W、X、Y、Z的化学式分别是:W,X,Y,Z。
-
(2) 以上4个化学反应,属于氧化还原反应的是(填反应序号)。
-
(3) 若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:。
②化学方程式:。
向含a mol (NH4)2Fe(SO4)2溶液中逐滴加入b mol NaOH溶液,下列说法不正确的是( )
A . (NH4)2Fe(SO4)2是复盐
B . b = a时,溶液中离子浓度大小关系为:c(Fe2+) = c(NH4+)
C . b = 2a时,发生的离子反应为: Fe2+ + 2OH-=Fe(OH)2 ↓
D . 当2a<b≤4a时可能发生的离子反应为:3 NH4+ + 2Fe2+ + 7OH-=2Fe(OH)2 ↓ + 3NH3·H2O
关于钠的描述正确的是( )
①钠在自然界既有游离态又有化合态存在
②金属钠着火可以用泡沫灭火器救火
③碳酸钠性质稳定,可治疗胃酸过多
④Na-K合金做原子反应堆的导热剂
⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜
⑥过氧化钠是淡黄色固体,可作漂白剂
A . ①②⑤
B . ④⑥
C . ③④
D . ②③④
下列离子组能大量共存且溶液为无色透明的是( )
A . K+、  、H+、Cu2+
B . Na+、OH-、Cl-、
、H+、Cu2+
B . Na+、OH-、Cl-、  C . H+、Na+、Cl-、
C . H+、Na+、Cl-、  D . Na+、Ba2+、
D . Na+、Ba2+、  、
、 
 、H+、Cu2+
B . Na+、OH-、Cl-、
、H+、Cu2+
B . Na+、OH-、Cl-、  C . H+、Na+、Cl-、
C . H+、Na+、Cl-、  D . Na+、Ba2+、
D . Na+、Ba2+、  、
、 
在体积都为1 L、pH都等于2的盐酸和醋酸溶液中,投入0.69 g 锌粒,则如图所示比较符合客观事实的是( )
A .  B .
B . 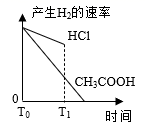 C .
C . 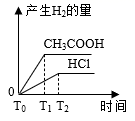 D .
D . 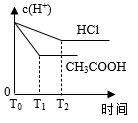
 B .
B .  C .
C .  D .
D . 
常温下,下列溶液中的粒子浓度关系正确的是( )
A . NH4Cl溶液中:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
B . Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42﹣)+ c(OH﹣)
C . NaHCO3溶液中:c(Na+)>c(HCO3﹣)>c(H+)>c(OH﹣)
D . 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1 mol/L
我国有丰富的海水资源 , 开发和利用海水资源是当前科学研究的一项重要任务。下列有关海水综合利用的说法错误的是( )
A . 从海水中提炼出的氘(含HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题,成为一条新的科学思路,HDO与H2O化学性质相同
B . 从海水中提取镁可以采用下列方法:海水 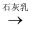 Mg(OH)2
Mg(OH)2  MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O  MgCl2(熔融)
MgCl2(熔融)  Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
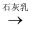 Mg(OH)2
Mg(OH)2  MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O  MgCl2(熔融)
MgCl2(熔融)  Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
某强酸性溶液X,可能含有Al3+、Ba2+、NH  、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO  、SO
、SO  、SiO
、SiO  、NO
、NO  中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO  、SO
、SO  、SiO
、SiO  、NO
、NO  中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题: 
-
(1) 由强酸性条件即可判断溶液X中一定不存在的离子有。
-
(2) 溶液X中,关于NO
 的判断一定正确的是。
的判断一定正确的是。 a.一定有 b.一定没有 c.可能有
-
(3) 产生气体A的离子方程式为。
-
(4) 转化⑥发生反应的现象为。
-
(5) 转化④中产生H的离子方程式为。
-
(6) 若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为。
-
(7) 气体F和气体A在催化剂条件下能够生成无毒无害的气体,写出反应的化学方程式。
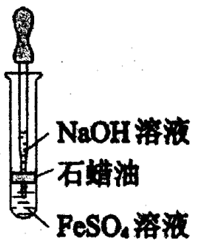
某化学兴趣小组对钠和钠的化合物进行了一系列的探究活动,下面是系列活动中的两个实验,请你回答下列问题:
-
(1) 实验I:探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置。B中盛有饱和碳酸氢钠溶液吸收挥发出的HCl,E为收集氧气装置。
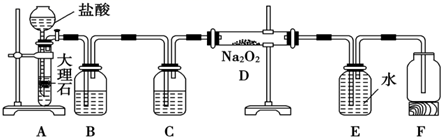
C中盛有,目的是。
-
(2) 指出装置E的不正确:。
-
(3) 取a g C3H6O2某物质在氧气中完全燃烧,将其产物跟足量的Na2O2固体完全反应,反应后固体的质量增加(填大于、等于或者小于)a g。
-
(4) 实验II:利用如图装置(省略夹持装置)模拟工业级NaN3的制备。
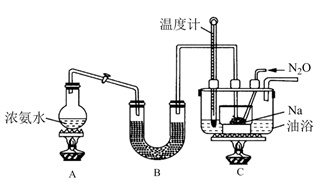
已知:2NaNH2+N2O
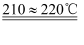 NaN3+NaOH+NH3
NaN3+NaOH+NH3装置B中盛放的药品为。
-
(5) 实验中使用油浴加热相比水浴加热的优点是。
-
(6) 氨气与熔融的钠反应生成NaNH2的化学方程式为。
-
(7) N2O可由NH4NO3(熔点为169.6℃)在240℃下分解制得,应选择的气体发生装置是。

下列分子或离子在指定的分散系中一定能大量共存的一组是( )
A . 中性溶液中:  、
、  、
、 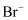 、
、  B . 与铝反应产生
B . 与铝反应产生  的溶液:
的溶液:  、
、 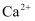 、
、  、
、  C . 使甲基橙呈红色的溶液:
C . 使甲基橙呈红色的溶液:  、
、  、
、  、
、 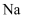 +
D . 透明澄清溶液:
+
D . 透明澄清溶液:  、
、  、
、  、
、 
 、
、  、
、 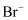 、
、  B . 与铝反应产生
B . 与铝反应产生  的溶液:
的溶液:  、
、 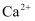 、
、  、
、  C . 使甲基橙呈红色的溶液:
C . 使甲基橙呈红色的溶液:  、
、  、
、  、
、 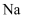 +
D . 透明澄清溶液:
+
D . 透明澄清溶液:  、
、  、
、  、
、 
下列实验装置能达到实验目的的是( )
A | B | C | D |
观察钾元素的焰色 | 制备氢氧化亚铁 | 称量固体NaOH | 比较Na2CO3、NaHCO3的稳定性 |
|
|
|
|
A . A
B . B
C . C
D . D
最近更新