第2节 研究物质性质的方法和程序 知识点题库
(1)实验室中少量钠常常保存在 中(填“煤油”或“水”);
(2)向氢氧化钠溶液中加入铝粉,反应生成的气体是 ;
(3)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是 (填字母代号).
A.FeO B.Fe2O3 C.Fe3O4 .
-
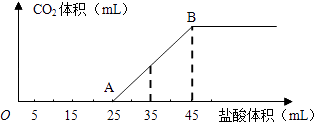
(1) 写出OA段所发生反应的离子方程式、
-
(2) 当加入35mL盐酸时,产生CO2的体积为 mL(标准状况).
-
(3) 计算原混合物中NaOH的质量及碳酸钠的质量分数.
-
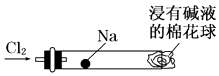
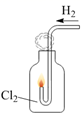
(1) 实验时甲同学在A装置中未加入任何试剂,发现B、C中的红色布条均褪色,由此甲同学得出结论:氯气具有漂白性.
实验时乙同学向A装置中加入了某种试剂,发现B中的红色布条不褪色而C中的红色布条褪色,由此乙同学得出结论:氯气没有漂白性.
你认为乙同学向A装置中加入的试剂是,甲、乙同学的结论正确的是.
-
(2) 丙同学思考后认为上面的实验装置存在缺陷,并提出了解决方法.你认为存在的缺陷是,解决方法为(用化学方程式表示).
-
(3) 丁同学在A装置中加入滴有酚酞的NaOH溶液,观察到A装置中溶液红色逐渐褪去.他提出两种可能原因:①氯气与水反应生成次氯酸,次氯酸具有强氧化性将酚酞氧化使溶液褪色;②氯气与NaOH溶液反应使溶液褪色.请你帮助他设计一个简单的实验验证褪色的原因(简述实验步骤)..
-
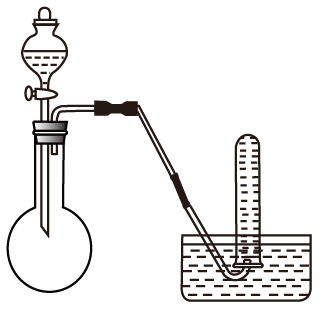
(1) 钠跟水剧烈反应,生成和,此实验说明钠的化学性质活泼.
-
(2) 钠有两种氧化物,其中用于呼吸面具和潜水艇中作为氧气来源的氧化物是,该物质中氧元素的化合价为.
-
(3) 固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是.

-
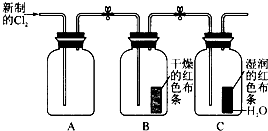
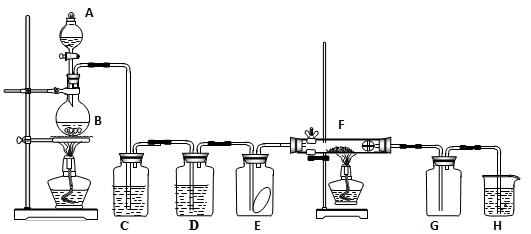
(1) 装置C中盛装的溶液是,D中试剂的作用是。
-
(2) E中的红色布条是否退色?,写出F中反应的化学反应方程式:,其反应现象为。
-
(3) 新制氯水呈黄绿色说明其中含有,(填化学式,下同),将紫色石蕊溶液滴入可观察到的现象是,说明其中含有。
-
(4) H中的试剂为,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为。
-
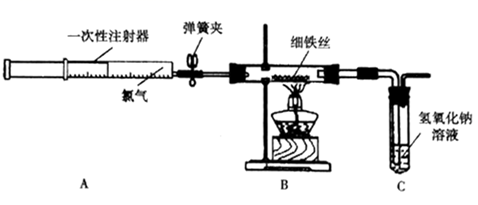
(1) 实验开始前需进行的一项操作是。
-
(2) 加热玻璃管中的铁丝约1min,打开弹簧夹,推动注射器的活塞注入一定量氯气,玻璃管内的现象是,有关反应的化学方程式是。
-
(3) 用氯气将玻璃管内的少量生成物吹入氢氧化钠溶液中,预测试管中可能产生的现象是。连接B与C的导管较粗,其目的是。
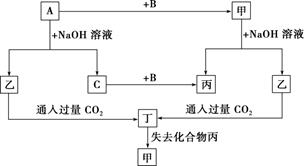
根据以上转化关系回答下列问题:
-
(1) 写出下列物质的化学式:A;B;乙;丁。
-
(2) ①写出 A 与 NaOH 溶液反应的化学方程式:。
②写出甲与 NaOH 溶液反应的离子方程式:。
-
(3) 将一定量的 A 加入 NaOH 溶液中,产生的 C 在标准状况下的体积为 3.36 L,则消耗的 A的物质的量为,转移电子的物质的量为。
-
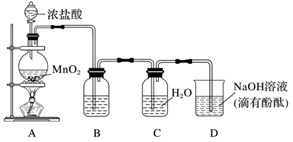
(1) Cl2有毒,实验前一定要检查装置的气密性。用文字表述检查这套装置气密性良好的方法及现象:。
-
(2) 装置B中所盛试剂是。
-
(3) 装置D用于吸收多余的氯气,其中所盛试剂能否换成氢氧化钙?并说明理由:。
-
(4) 同学们观察到装置D中红色褪去,并对褪色原因提出假设:
①ClO-破坏了酚酞的结构;
②。
该小组同学设计实验,取少许装置D中褪色后的溶液于试管中,请将后续操作和现象补充完整),证实了假设②不能成立。
-
(5) 取装置C中所得溶液,观察到溶液呈浅黄绿色,用pH计测量,读数为1.52。
①以上信息中可以证明氯气分子与水发生了化学反应的是,能说明反应是有一定限度的。测量pH时不能用pH试纸代替pH计,原因是。
②已知:Cl2(g)+H2O(l)
 H+(aq)+Cl-(aq)+HClO(aq) △H>0,该小组同学进一步探究氯气与水反应的可逆性:向20 mL饱和氯水中滴加1 mL浓硫酸,利用化学型传感器测量氯化物的含量随时间变化的关系(如图所示),从而判断溶液中Cl-的含量。
H+(aq)+Cl-(aq)+HClO(aq) △H>0,该小组同学进一步探究氯气与水反应的可逆性:向20 mL饱和氯水中滴加1 mL浓硫酸,利用化学型传感器测量氯化物的含量随时间变化的关系(如图所示),从而判断溶液中Cl-的含量。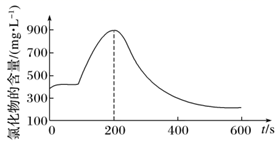
200s前,氯化物的含量突然增大的原因可能是;用平衡移动原理分析在200s后,氯化物的含量随时间减小的原因。
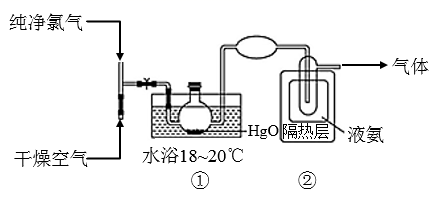
已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃;NH3的熔点为-77.8℃,沸点为-33.5℃。下列说法错误的是( )
-
(1) 常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是。(填写序号,下同)
-
(2) 常用于焙制糕点的是;日常生活中常用作消毒的是。
-
(3) 实验室要放在棕色试剂瓶中保存是;除了⑤之外,能与NaOH溶液反应(NaOH参与反应)的是。
-
(4) 在高温条件下金属铝与③发生置换反应的化学方程式为。
| | | | |
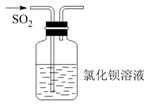
| A.将浓盐酸滴入后产生黄绿色气体 | B.少量SO2通入氯化钡溶液,产生白色沉淀 | C.出现苍白色火焰,集气瓶口有白雾 | D.试管中产生白色沉淀,较长时间不变色 |
选项 | A | B | C | D |
实验目的 | 制备Cl2 | 制备并收集NO | 配制0.10 | 检验CO2中混有的CH4 |
实验试剂 | 浓盐酸和二氧化锰 | Cu和稀硝酸 | 水和NaOH(s) | I中澄清石灰水,II中溴水 |
实验装置 |
|
|
|
|
-
(1) 任务一:某小组研究
 和
和 的性质,实验如下:
的性质,实验如下:序号
操作
现象

①
在两支试管中加入
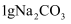 或
或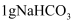 固体,再加入5mL水,振荡;将温度计分别插入其中
固体,再加入5mL水,振荡;将温度计分别插入其中温度由17.6℃变为23.2℃;放置至室温时,试管内无固体
温度由17.6℃变为17.2℃;放置至室温时,试管内有少量固体残留
②
室温时,分别向①所得溶液中滴入2滴酚酞溶液
溶液变红
溶液微红
室温下,
 的溶解度大于
的溶解度大于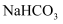 的实验证据是。
的实验证据是。 -
(2) 该实验不能说明
 溶液的碱性强于
溶液的碱性强于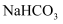 溶液,理由是。
溶液,理由是。
-
(3) 任务二:为进一步探究
 和
和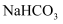 的性质,利用传感器继续做如下实验:
的性质,利用传感器继续做如下实验:编号
实验操作
实验数据
③
测量下面实验过程中温度的变化


④
测量下面实验过程中溶液
 的变化
的变化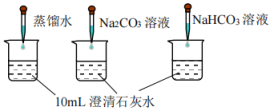
注:
 溶液和
溶液和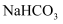 溶液的浓度相等
溶液的浓度相等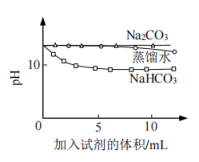
信息提示:溶液
 越小,
越小,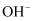 的浓度越小,溶液碱性越弱。
的浓度越小,溶液碱性越弱。澄清石灰水显碱性,用电离方程式表示其原因是。
-
(4) 实验③中,溶解时吸收热量的物质是(填化学式)。
-
(5) 实验④中,
 溶液和澄清石灰水反应的离子方程式为,
溶液和澄清石灰水反应的离子方程式为,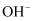 未参与该反应的实验证据是。
未参与该反应的实验证据是。
-
(6) 实验④中,滴加
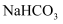 溶液的烧杯中溶液
溶液的烧杯中溶液 的变化与滴加
的变化与滴加 溶液的
溶液的 有明显差异,原因是滴加
有明显差异,原因是滴加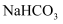 溶液的烧杯中(填离子符号)参与了反应,写出反应初期的离子方程式:。
溶液的烧杯中(填离子符号)参与了反应,写出反应初期的离子方程式:。

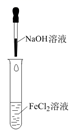
 NaOH溶液
NaOH溶液