第2节 研究物质性质的方法和程序 知识点题库
应用Na2CO3和NaHCO3的下列性质设计实验,不能够鉴别Na2CO3和NaHCO3固体的是
A . 水溶性
B . 热稳定性
C . 与酸反应
D . 焰色反应
下列关于Na2O和Na2O2的叙述正确的是( )
A . 都是白色固体
B . 都能和水反应形成强碱溶液
C . 都是碱性氧化物
D . 都是强氧化剂
用如图所示装置进行实验,回答有关问题:

-
(1) 玻璃管E内发生反应的化学方程式为.
-
(2) 小试管C的作用是.
-
(3) 广口瓶D内盛的试剂是,
-
(4) 若U形管内收集到的物质很少,分析其原因,不可能的是.(填序号)
①装置气密性不好
②制得的SO2中混有少量H2S杂质,使催化剂中毒
③气流速度过快
-
(5) 从U形管导出的尾气的处理方法是.
饮用水质量是关系人类健康的重要问题.
-
(1) 氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为.
-
(2) 写出工业上制取漂白粉的化学反应方程式:.
-
(3) ClO2被称为“第四代”饮用水杀虫剂,因其高效率,无污染而被广泛使用.制备ClO2是发达国家普遍重视的课题,我国北京永利科技有限公司已用电解法批量生产ClO2 . 其反应原理为:4ClO3﹣+4H+═4ClO2+O2↑+2H2O,则氧化剂:;还原剂:.
-
(4) 相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是.
①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠,1mol上述固体物质长期放置于空气中,下列说法正确的是( )
A . 质量增加的情况是②>①>③>④
B . 质量增加的情况是①>③>④>②
C . 上述物质都有发生了氧化还原反应
D . 过氧化钠在反应中转移了2 mol电子
将钠和碳分别置于如图所示的两个盛满足量氧气的集气瓶中燃烧完毕后,同时打开装置中的两个止水夹,这时观察到( )

A . 水进入左瓶
B . 水进入右瓶
C . 水同时进入两瓶
D . 水不进入任何一瓶
化学与社会、生产、生活密切相关。下列说法正确的是( )
A . 碳纤维是一种新开发的材料,它属于合成有机高分子化合物
B . 对“地沟油”进行分馏可得到汽油
C . 漂白粉长期暴露在空气中最后会变质失效
D . 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用
下列解释实验现象的反应方程式正确的是( )
A . 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
B . 金属钠比通金属铜活泼,金属钠放入CuSO4溶液:CuSO4+2Na=Cu+Na2SO4
C . Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2+2CO2=2Na2CO3+O2
D . 将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2,推测2Na2O2+2SO2= Na2SO3+ O2是不符合题意的,应该是Na2O2+SO2= Na2SO4。下列各组类比中正确的是( )
A . 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2
B . 由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C . 铝和硫直接化合能得到Al2S3, 推测:铁和硫直接化合也能得到 Fe2S3
D . 由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2CO3+2HCl =2NaCl +H2O+ CO2↑
下列各组中两种物质作用时,温度和反应物用量改变不会引起产物种类变化的是 ( )
A . Na和O2
B . S和O2
C . CO2和Ca(OH)2溶液
D . Fe和稀硝酸
NaClO广泛用作消杀剂、水处理剂及漂白剂等。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。

-
(1) 向NaClO溶液中通入CO2 , 发生反应的离子方程式为(H2CO3的lgKa1、lgKa2依次为-6.38、-10.21);反应ClO-+H2O
 HClO+OH-的lgK=。
HClO+OH-的lgK=。
-
(2) 用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为。
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是。
-
(3) NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH
 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。 
①NaClO氧化NH3的化学方程式为。
②pH在3~7时,随pH增大氨氮去除率升高的原因是。
③pH在7~9时,随pH增大氨氮去除率降低的原因是。
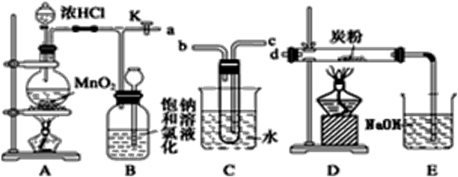
如图是某研究性学习小组设计制取氯气,并以氯气为反应物进行特定反应的装置。
-
(1) 写出A中反应的离子反应方程式:。要将C装置接入B和D之间,正确的接法是:a→→→d。
-
(2) 实验开始时先点燃A处酒精灯,打开旋塞K,让Cl2刚好充满整个装置,再点燃D处酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g)。
D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是,B的作用是。
-
(3) 在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由:。
-
(4) 实验结束后,测得D装置质量减轻1.92g,E中NaOH溶液(足量)增重36.08g,可算出D中反应的氯气转化率为。(转化率=D中参加反应的氯气的量/通入D中氯气总量)
图中为实验室制取氯气及性质验证的装置图:
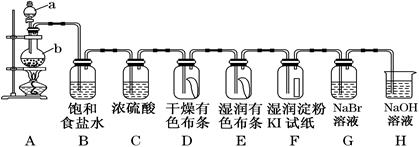
参考装置图回答下列问题:
-
(1) 请指出仪器a的名称写出装置A中反应的离子方程式
-
(2) 在装置D中可观察到的现象是,装置E中可观察到的现象是。
-
(3) 装置B的作用为,装置C的作用为,装置H的作用为,
-
(4) 写出装置H中的离子方程式。
-
(1) ①写出水玻璃溶质的化学式;②写出丙酸的结构简式。
-
(2) 漂白粉漂白的原理:。
已知Fe(OH)3为红褐色,下列关于钠的反应现象的叙述中,错误的是( )
| 选项 | 反应内容 | 主要反应现象 |
| A | 切开钠,观察其颜色的变化 | 钠切面颜色变暗 |
| B | 把小块钠投入硫酸铁溶液中 | 钠浮在水面上、四处游动、产生红褐色沉淀 |
| C | 把小块钠投入饱和氢氧化钠溶液中 | 钠浮在水面上、四处游动、产生白色浑浊 |
| D | 把燃着的钠伸入盛有氯气的集气瓶中 | 钠与氯气剧烈反应,产生大量白色烟雾 |
A . A
B . B
C . C
D . D
下列说法错误的是( )
A .  会破坏铝表面氧化膜的结构
B . 钢铁在潮湿空气中生锈主要是发生了化学腐蚀
C . 不可以向人体注射消毒水来杀灭2019-nCoV
D .
会破坏铝表面氧化膜的结构
B . 钢铁在潮湿空气中生锈主要是发生了化学腐蚀
C . 不可以向人体注射消毒水来杀灭2019-nCoV
D .  的热稳定性比
的热稳定性比  强
强
 会破坏铝表面氧化膜的结构
B . 钢铁在潮湿空气中生锈主要是发生了化学腐蚀
C . 不可以向人体注射消毒水来杀灭2019-nCoV
D .
会破坏铝表面氧化膜的结构
B . 钢铁在潮湿空气中生锈主要是发生了化学腐蚀
C . 不可以向人体注射消毒水来杀灭2019-nCoV
D .  的热稳定性比
的热稳定性比  强
强
按要求回答下列问题:
-
(1) 写出
 的电子式;
的电子式;
-
(2) 用电子式表示
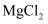 的形成过程;
的形成过程;
-
(3) 写出
 的结构式,它的空间构型为;
的结构式,它的空间构型为;
-
(4) 写出铜和浓硫酸反应的化学方程式;
-
(5) 写出实验室用
 代替
代替  制氯气的离子方程式。
制氯气的离子方程式。
下列图示方法能完成相应实验的是( )
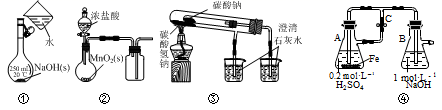
A . 用图①配制一定物质的量浓度的NaOH溶液
B . 用图②在实验室制取Cl2
C . 用图③探究碳酸氢钠和碳酸钠的热稳定性
D . 用图④制备少量Fe(OH)2并能较长时间看到其白色
下列关于氯及其化合物的性质与用途具有对应关系的是( )
A . Cl2易液化,可用于生产盐酸
B . ClO2有强氧化性,可用于自来水消毒
C . CCl4难溶于水,可用作灭火剂
D . HCl极易溶于水,可用于检验NH3
下列物质应用正确的是( )
A . 泡沫灭火器可用于金属钠着火时灭火
B . 碳酸钡可用于胃肠X射线造影检查
C . 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D . 用淀粉检验食盐中的碘元素
最近更新



