第2节 研究物质性质的方法和程序 知识点题库
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
-
(1) NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
-
(2) Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
-
(3) KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
-
(4) NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
-
(5) 100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况).
①用碱石灰除去的物质为
②该产气药剂中NaN3的质量分数为
氯气能使紫色石蕊溶液( )
A . 褪色
B . 变成红色
C . 先褪色后变红
D . 先变红后褪色
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,测定过氧化氢的含量。
请填写下列空白:
-
(1) 移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
-
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式:
-
(3) 滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
-
(4) 重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为。
-
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏高”、“偏低”或“不变”)。
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A . 将石灰石加入新制氯水中,固体逐渐溶解(H+)
B . 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
C . 使红色布条退色(HCl)
D . 滴加AgNO3溶液生成白色沉淀(Cl﹣)
实验室用浓盐酸、二氧化锰共热制氯气,但是氯气是有毒的污染性气体,在制取的过程中必须在通风橱内进行.下图是某研究性学习小组设计的在没有通风橱的情况下,收集纯净的氯气,图中A、B是可控制的弹簧夹.

-
(1) 写出制取氯气的化学方程式
-
(2) 烧杯中盛放的液体是,其作用是,写出其作用的反应离子方程式:.
-
(3) 水槽中应盛放的液体是.
-
(4) 简述操作过程:
①开始收集氯气:应打开,关闭;
②氯气收集完毕:应打开,关闭.
下列有关氯气的叙述,其说法正确的是( )
A . 在通常情况下氯气比空气重
B . 点燃是使氯气和氢气化合的唯一条件
C . 氯气跟铁反应生成FeCl2
D . 将红热的铜放入氯气中生成蓝色氯化铜
实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
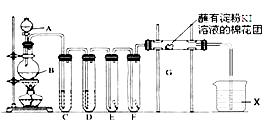
-
(1) A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式。
-
(2) E中为红色干布条,F中为红色湿布条,可观察到的现象是,对比E和F中现象的差异可得出的结论及解释是。
-
(3) 试管C和D中试剂各为、。
-
(4) 装置G处发生反应的离子方程式为。
-
(5) 用离子方程式表示试剂X的作用。
-
(6) 家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式。
②需“密闭保存”的原因。
下列说法中正确的是 ( )
A . 向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B . pH在5.6~7之间的降水通常称为酸雨
C . 合金的熔点一般比成分金属的低
D . 硫粉在过量的纯氧中燃烧可生成SO3
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
-
(1) 写出装置A中发生反应的离子方程式:,D中发生反应的化学方程式。
-
(2) A中g管的作用是,装置C中的试剂是,作用是。
-
(3) 装置E中的h瓶需要冷却的理由是。
-
(4) 装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
-
(5) 过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式。
实验室可用氯气和金属铁反应制备无水三氧化铁,该化合物呈棕红色、易潮解,100℃左右时升华。装置如下:

-
(1) 仪器a的名称是。
-
(2) A中反应的化学方程式是。
-
(3) 碱石灰的作用是。
-
(4) 反应开始时,先点燃处的酒精灯(填“A”或“D”)。
-
(5) D中反应开始后,收集器中有大量棕红色烟生成,反应结束后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加水溶解,充分反应后,加入KSCN溶液未变红色,其原因是。(用离子方程式表示)。
下列有关卤素的说法不正确的是( )
A . 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
B . HF、HCl、HBr、HI的还原性依次增强
C . 淀粉-碘化钾酸性溶液在空气中变蓝,4I-+O2+4H+=2I2+2H2O
D . 次氯酸盐具有氧化性,故漂白粉可以漂白织物
通过所学知识,回答下面问题
-
(1) 写出铁与水蒸气在高温下反应方程式。
-
(2) 加热碳酸氢钠的化学方程式为
-
(3) 在呼吸面具中,Na2O2起反应的化学方程式为。当有7.8克Na2O2反应时,放出氧气的质量为。
-
(4) 将铜片投入到FeCl3溶液中恰好完全反应,发生的反应离子方程式为。
-
(5) 向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式: 。
下列实验现象描述错误的是( )
A . 氢气在氯气中燃烧,火焰呈苍白色
B . 钠在氯气中燃烧火焰呈黄色
C . 铁丝在氯气中燃烧时产生棕褐色烟雾
D . 氯气的水溶液呈浅黄绿色
将氯气制成漂粉精的主要目的是:①使它转变为较易溶于水的物质②转变为较稳定、便于贮存和运输的物质③提高氯的百分含量④提高漂白能力( )
A . ①②
B . ②③
C . ①②④
D . 只有②
Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
-
(1) NaOH溶液的物质的量浓度mol·L-1;
-
(2) 某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =mol·L-1。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
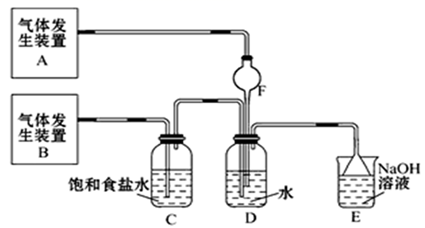

-
(1) 该化学兴趣小组的同学现采用Na2SO3与70%的硫酸为原料制取SO2 , 采用MnO2和浓盐酸(12mol/L)为原料制取Cl2,在此实验中,F仪器的作用是;气体发生装置B应选择以上三种装置中的(填序号)。
-
(2) 装置D中主要反应的离子方程式为。
-
(3) 为验证通入装置D中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液②氯化亚铁溶液③硫氰化钾溶液④品红溶液
若Cl2过量,取适量D中溶液滴加至盛有(填一个序号)的试管内,再加入(填一个序号)。产生的现象是。
若SO2过量,取适量D中溶液滴加至盛有(填一个序号)的试管内,产生的现象是。
下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 操作 |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大的一块,小心放入装满水的烧杯中 |
| B | 除去 | 对固体混合物进行加热 |
| C | 证明 | |
| D | 制取氢氧化铁胶体 | 将0.01mol/L NaOH溶液滴入0.1mol/L |
A . A
B . B
C . C
D . D
纯净物A、B、C、D的组成中至少有一种元素相同,它们之间有如图转化关系(部分条件和产物省略)。

回答下列问题:
-
(1) 若A为金属单质,C为浅黄色粉末,常温常压下Y为液态氧化物,则B的化学式为,C→D的离子方程式为。
-
(2) 若A是非金属单质,C是光合作用的原料,A和C在高温下生成B,则该反应中氧化产物和还原产物的质量之比为。
-
(3) 若A为黄绿色气体,X为金属单质,B为X在A中燃烧生成的棕黄色的烟,写出A和X反应的化学方程式:;氢气在A中燃烧可观察到的现象为,该反应中氧化剂和还原剂的物质的量之比为。
下列有关钠及其化合物的说法正确的是( )
A . 钠着火可用泡沫灭火器扑灭
B . 氧化钠可用作呼吸面具的供氧剂
C . NaCl与NaOH灼烧时火焰颜色相同
D . 苏打可用于治疗胃酸过多
钠元素在自然界都以化合物的形式存在。
-
(1) 过氧化钠中氧元素的化合价为价,焰色试验为色。
-
(2) 过氧化钠用于呼吸面具的反应方程式为,,若有2mol的过氧化钠参与反应,转移的电子的物质的量为mol。
最近更新
 固体中的
固体中的 
 与水反应放出热量
与水反应放出热量 溶液中
溶液中


