第2节 电解质 知识点题库
下列各组离子在无色酸性溶液中可以大量共存的有( )
A . Ag+、K+、NO3﹣、Cl ﹣
B . K+、Cu2+、SO42﹣、HCO3﹣
C . Mg2+、Cl﹣、SO42﹣、Na+
D . CO32﹣、K+、NO3﹣、Na+
下列反应的离子方程式书写正确的是( )
A . 氧化钠投入水中:O2-+H2O=2OH-
B . FeCl3溶液与HI反应:2Fe3++2I-=2Fe2++I2
C . 硫酸氢铵与过量氢氧化钡溶液反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
D . 过量CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO-=2HClO+CaCO3↓
下列说法正确的是( )
A . CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<O
B . 若在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀
C . 1molNa2O2与足量H2O反应产生O2 , 理论上转移的电子数约为2×6.02×1023
D . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
向一定量的NaOH溶液中逐滴加AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。 则下列离子组在对应的溶液中一定能大量共存的是( )

A . a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B . b点对应的溶液中:Na+、S2-、SO42-、Cl-
C . c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D . d点对应的溶液中:K+、NH4+、I-、HCO3-
下列反应的离子方程式书写正确的是( )
A . 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B . 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C . 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓
D . 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
有关电解质的说法正确的是( )
A . Na2O液态时能导电,所以Na2O是电解质
B . SO3水溶液的导电性很好,所以SO3是电解质
C . 液态的铜导电性很好,所以铜是电解质
D . 固体NaCl不导电,所以NaCl不是电解质
与离子方程式Fe3++3OH-=Fe(OH)3↓相对应的化学方程式是( )
A . FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
B . 2Fe(NO3)3+3Mg(OH)2=2Fe(OH)3↓+3Mg(NO3)2
C . Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓
D . Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
向
100mL1.5mol/L 的 NaOH 溶液中缓慢通入一定量的 CO2 ,充分反应后,向所得溶液中逐滴缓慢滴加稀盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。

-
(1) 通入一定量的 CO2 充分反应后的溶液中溶质为(写化学式)
-
(2) AB 段所发生的离子方程式:。
-
(3) 滴加稀盐酸的物质的量浓度为mol/L。
-
(4) 通入二氧化碳的体积为L(在标准状况下)。
下列物质中所含微粒的个数比是1∶1的是( )
A . CH3COONa溶液中CH3COO-和Na+
B . NH4+中的质子和电子
C . Na2O2固体中阴、阳离子
D . 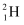 原子中的质子和中子
原子中的质子和中子
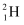 原子中的质子和中子
原子中的质子和中子
下列有关电解质溶液的说法正确的是( )
A . NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
B . 为处理锅炉水垢中的CaSO4 , 可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C . 室温下,向0.1 mol/L的 CH3COOH溶液中加入少量水,溶液中所有离子浓度都降低
D . 将Ca(ClO)2、CaSO4、FeCl3溶液蒸干均得不到原溶液
能正确表示下列化学反应的离子方程式是( )
A . 用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
B . 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C . 铁片插入硝酸银溶液中:Fe+Ag+=Fe2++Ag
D . 碳酸钡溶于稀盐酸中:  +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
下列关于离子共存或者离子反应的说法正确的是( )
A .  溶液可能大量存在:
溶液可能大量存在:  、
、  、
、  、
、  B . 用NaOH溶液吸收过量CO2:
B . 用NaOH溶液吸收过量CO2:  C .
C .  氯化亚铁溶液:Na+、
氯化亚铁溶液:Na+、  、
、  、MnO
、MnO  D . 氢氧化铁和碘化氢溶液反应:
D . 氢氧化铁和碘化氢溶液反应: 
 溶液可能大量存在:
溶液可能大量存在:  、
、  、
、  、
、  B . 用NaOH溶液吸收过量CO2:
B . 用NaOH溶液吸收过量CO2:  C .
C .  氯化亚铁溶液:Na+、
氯化亚铁溶液:Na+、  、
、  、MnO
、MnO  D . 氢氧化铁和碘化氢溶液反应:
D . 氢氧化铁和碘化氢溶液反应: 
有以下几种物质 ①氯化钠晶体 ②液态HCl ③二氧化碳气体 ④稀硫酸 ⑤乙醇
⑥铁丝⑦熔融的氢氧化钠 ⑧空气,请回答:(填序号)
-
(1) 属于电解质的是;
-
(2) 属于非电解质的是;
-
(3) 该状态下能导电的是。
下列化学用语表示正确的是( )
A . 超重氢的符号:D
B . 碳铵的化学式:NH4HCO3
C . 镁离子的结构示意图:  D . 氢氧化钡在水溶液中的电离方程式: Ba(OH)2=Ba2++(OH)
D . 氢氧化钡在水溶液中的电离方程式: Ba(OH)2=Ba2++(OH) 
 D . 氢氧化钡在水溶液中的电离方程式: Ba(OH)2=Ba2++(OH)
D . 氢氧化钡在水溶液中的电离方程式: Ba(OH)2=Ba2++(OH) 
下列离子方程式正确的是( )
A . 如图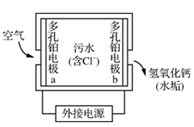 , 铂电极a反应:O2+4e-+2H2O=4OH-
B . 氯气溶于水:Cl2+H2O
, 铂电极a反应:O2+4e-+2H2O=4OH-
B . 氯气溶于水:Cl2+H2O  H++Cl-+HClO
C . 醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+=Ca2++2H2O
D . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HC
H++Cl-+HClO
C . 醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+=Ca2++2H2O
D . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HC 
 , 铂电极a反应:O2+4e-+2H2O=4OH-
B . 氯气溶于水:Cl2+H2O
, 铂电极a反应:O2+4e-+2H2O=4OH-
B . 氯气溶于水:Cl2+H2O  H++Cl-+HClO
C . 醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+=Ca2++2H2O
D . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HC
H++Cl-+HClO
C . 醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+=Ca2++2H2O
D . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HC 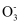
某研究性学习小组为探究醋酸的电离情况,进行了如下实验:
-
(1) 取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对该醋酸溶液的浓度进行标定。
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。解稀释过程中a、b、c点对应溶液的pH由大到小的顺序为。

②为标定稀释所得醋酸溶液的准确浓度,用0.2000mol/L的NaOH标准溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
实验序号
1
2
3
4
消耗NaOH溶液的体积(mL)
20.05
20.00
18.80
19.95
该醋酸溶液的准确浓度为mol/L。上述标定过程中,会造成测定结果偏高的原因可能是(填字母)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
-
(2) 该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度醋酸的pH,其结果如表:
醋酸浓度(mol/L)
0.0010
0.0100
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.73
①根据表中数据,可得出醋酸是弱电解质的结论,你认为得出此结论的依据是。
②从表中数据还可得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将(填“增大”、“减小”或“不变”)。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:。
下列事实中不能证明 是弱电解质的是( )
是弱电解质的是( )
 是弱电解质的是( )
是弱电解质的是( )
A . 常温下某浓度的 溶液的
溶液的 B . 用某
B . 用某 溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与
溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与 溶液分别和足量锌反应,
溶液分别和足量锌反应, 放出的氢气较多
D . 将
放出的氢气较多
D . 将 的
的 溶液稀释100倍,稀释后溶液的
溶液稀释100倍,稀释后溶液的
 溶液的
溶液的 B . 用某
B . 用某 溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与
溶液做导电实验,灯泡很暗
C . 等体积等pH的盐酸与 溶液分别和足量锌反应,
溶液分别和足量锌反应, 放出的氢气较多
D . 将
放出的氢气较多
D . 将 的
的 溶液稀释100倍,稀释后溶液的
溶液稀释100倍,稀释后溶液的
下列物质属于弱电解质的是( )
A . 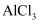 B .
B .  C .
C .  D .
D . 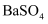
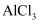 B .
B .  C .
C .  D .
D . 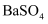
侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
有一包固体粉末,其中可能含有NaCl、Ba(NO3)2、K2SO4、Na2CO3、NaNO3中的一种或几种,现做以下实验:
①取部分固体粉末加入水中,振荡,有白色沉淀生成;
②向①的沉淀物中加入足量稀盐酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入硝酸银溶液,有白色沉淀产生。试根据上述实验事实,回答下列问题:
-
(1) 原固体粉末中一定含有的物质是,一定不含的物质是,可能含有的物质是。(以上各种物质均写化学式)
-
(2) 写出上述步骤中发生反应的离子方程式:
①
②
③
最近更新



