第2节 电解质 知识点题库
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
-
(1) 过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2 , 它具有Na2CO3和H2O2的双重性质
①H2O2有时可作为矿业 废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为,
②某强酸性反应体系中,反应物和生成物共 六种物质:O2、MnO4﹣、H2O、Mn2+、H2O2、H+ . 已知该反应中H2O2只发生了如下过程:H2O2→O2 . 写出该反应的离子方程式:.
-
(2) 漂白剂亚氯酸钠(NaClO 常温与黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl﹣+H2O(未配平).在该反应中,当有1mol ClO2生成时转移电子的物质的量是.
下列物质混合后,不会发生离子反应的是( )
A . NaOH溶液和FeCl3溶液
B . Na2CO3溶液和稀硫酸
C . Na2SO4溶液和MgCl2溶液
D . CuSO4溶液和Ba(OH)2溶液
某溶液中可能含有Na+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、CO32-、S2-、SO32-、AlO2-、Cl-、SO42-中的一种或几种,对该溶液进行实验,结果如图:

下列说法错误的是( )
A . 淡黄色沉淀甲为AgBr,沉淀乙为Al(OH)3
B . 溶液中一定含有Na+、S2-、SO32-、AlO2-
C . 气体甲的成分可能是CO2或SO2或H2S或CO2、SO2的混合气体或CO2、H2S的混合气体
D . 确定溶液A中是否含有SO42- , 可在沉淀丙中加入足量稀盐酸,若沉淀部分溶解则溶液A中含有SO42- , 若沉淀全部溶解则溶液A中不含SO42-
下列有关化学符号表征正确的是( )
A . 电解法精炼铜,阴极电极反应:Cu2++2e-=Cu
B . H2S在水溶液中的电离:H2S  2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O
2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O  2OH-+H2CO3
2OH-+H2CO3
 2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O
2H++S2-
C . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) ==CO2 (g)+2H2O (g) ΔH=-890.3kJ·mol-1
D . 碳酸钠水解的离子方程式:CO32-+2H2O  2OH-+H2CO3
2OH-+H2CO3
现有一包固体粉末,其中可能含有如下五种物质:CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4。已知CaCO3难溶于水,CuSO4溶液呈蓝色。现进行如下实验:①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。根据上述实验现象推断:
-
(1) 一定不存在的物质是;
-
(2) 一定存在的物质是;
-
(3) 可能存在的物质是;
-
(4) 检验可能存在的物质所用试剂为:.
下列指定反应的离子方程式正确的是( )
A . NH4HCO3溶液和过量Ca(OH)2溶液混合:Ca2++NH4++HCO3-+2OH-=CaCO3↓+H2O+NH3∙H2O
B . NaClO溶液与HI溶液反应:2ClO-+2H2O+2I-=I2+Cl2↑+4OH-
C . 磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D . 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )

A . 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B . 等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C . 在pH=3的溶液中存在  =10-3
D . 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
=10-3
D . 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
 =10-3
D . 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
=10-3
D . 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、 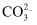 、OH-六种离子中的三种,已知乙烧杯中的溶液呈无色,则乙烧杯的溶液中大量存在的离子是( )
、OH-六种离子中的三种,已知乙烧杯中的溶液呈无色,则乙烧杯的溶液中大量存在的离子是( )
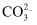 、OH-六种离子中的三种,已知乙烧杯中的溶液呈无色,则乙烧杯的溶液中大量存在的离子是( )
、OH-六种离子中的三种,已知乙烧杯中的溶液呈无色,则乙烧杯的溶液中大量存在的离子是( )
A . Cu2+、H+、Cl-
B . Cl-、 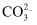 、OH-
C . K+、H+、Cl-
D . K+、OH-、
、OH-
C . K+、H+、Cl-
D . K+、OH-、 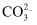
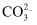 、OH-
C . K+、H+、Cl-
D . K+、OH-、
、OH-
C . K+、H+、Cl-
D . K+、OH-、 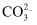
下列离子方程式正确的是( )
A . 澄清石灰水与过量CO2反应CO2+Ca2++2OH-=CaCO3↓+H2O
B . 石灰乳与稀盐酸反应H++OH-=H2O
C . CH3COOH溶液与NaOH溶液反应H++OH-=H2O
D . 用碳酸氢钠作为抗酸药中和胃酸H++ 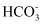 =H2O+CO2↑
=H2O+CO2↑
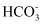 =H2O+CO2↑
=H2O+CO2↑
下列说法中正确的是 ( )
A . 碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物
B . 硫酸钡难溶于水,所以硫酸钡是弱电解质
C . CO2、NH3的水溶液可以导电,所以CO2、NH3是电解质
D . 强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱
下列离子方程式中,错误的是( )
A . 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B . 氯化钡溶液与硫酸反应:Ba2++  =BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
=BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
 =BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
=BaSO4↓
C . 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
下列离子方程式正确的是( )
A . 碳酸氢钠与醋酸反应:HCO  +H+=CO2↑+H2O
B . 等物质的量的硫酸氢钠与氢氧化钡溶液:SO
+H+=CO2↑+H2O
B . 等物质的量的硫酸氢钠与氢氧化钡溶液:SO  +H++Ba2++OH-=H2O+BaSO4↓
C . 氯化铁溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓
D . 金属钠与H2O反应:Na+H2O=Na++OH-+H2↑
+H++Ba2++OH-=H2O+BaSO4↓
C . 氯化铁溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓
D . 金属钠与H2O反应:Na+H2O=Na++OH-+H2↑
 +H+=CO2↑+H2O
B . 等物质的量的硫酸氢钠与氢氧化钡溶液:SO
+H+=CO2↑+H2O
B . 等物质的量的硫酸氢钠与氢氧化钡溶液:SO  +H++Ba2++OH-=H2O+BaSO4↓
C . 氯化铁溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓
D . 金属钠与H2O反应:Na+H2O=Na++OH-+H2↑
+H++Ba2++OH-=H2O+BaSO4↓
C . 氯化铁溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓
D . 金属钠与H2O反应:Na+H2O=Na++OH-+H2↑
下列离子方程式书写正确的是( )
A . 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B . 碳酸钙与盐酸反应:CO  +2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO  +H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO
+H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO  =BaSO4↓
=BaSO4↓
 +2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO  +H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO
+H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO  =BaSO4↓
=BaSO4↓
下列物质属于电解质的是( )
A . 硫酸溶液
B . 氯化钠
C . 液氯
D . 乙醇
下列离子在强碱性溶液中能大量共存的是( )
A . Al3+、Na+、  、
、  B . K+、Fe2+、ClO-、I-
C . Na+、K+、
B . K+、Fe2+、ClO-、I-
C . Na+、K+、  、
、  D . Ba2+、Na+、
D . Ba2+、Na+、  、
、 
 、
、  B . K+、Fe2+、ClO-、I-
C . Na+、K+、
B . K+、Fe2+、ClO-、I-
C . Na+、K+、  、
、  D . Ba2+、Na+、
D . Ba2+、Na+、  、
、 
高铁酸钾(K2FeO4)是一种新型高效消毒净水剂。高铁酸钾的一种实验室制法如下。(装置如图所示,夹持装置略去)
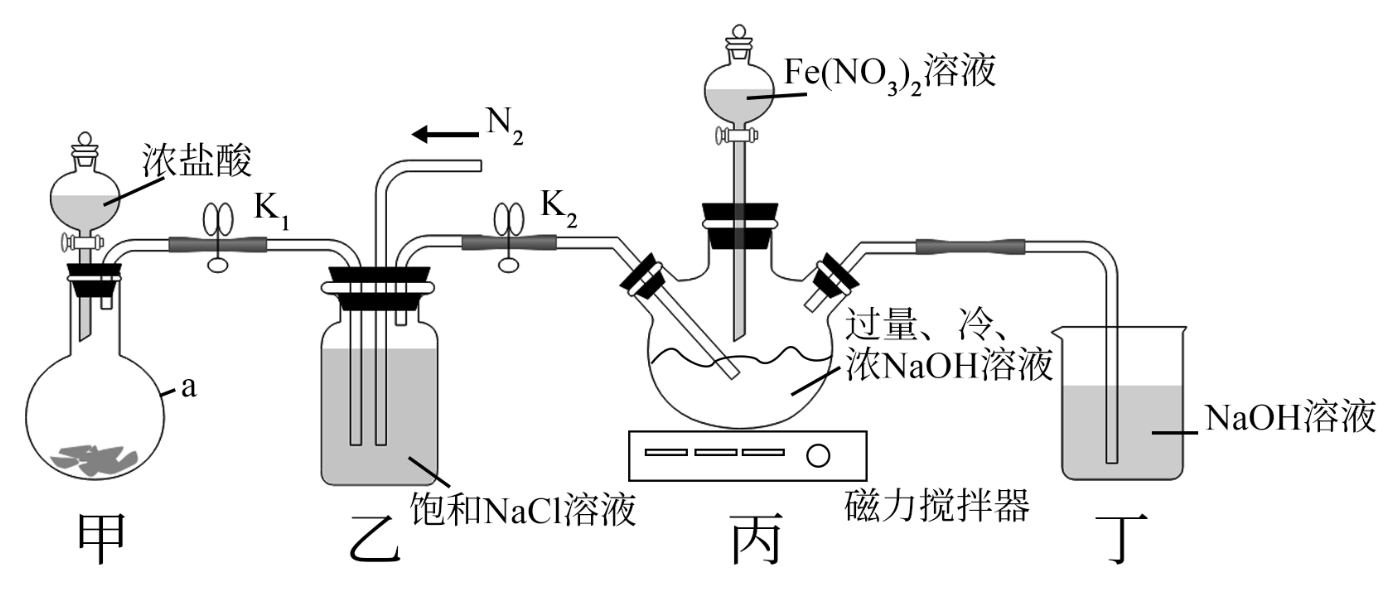
Ⅰ.组装好仪器,检查装置气密性,装入药品。
Ⅱ.打开止水夹K1、K2和甲中分液漏斗活塞,反应一段时间,关闭止水夹K1。
Ⅲ.开启磁力搅拌器,缓慢加入100mL0.8mol•L-1Fe(NO3)3溶液,充分反应。
Ⅳ.反应结束,通入N2一段时间,取下三颈烧瓶,在低温下加入KOH固体至溶液饱和,析出粗产品,过滤。
Ⅴ.将粗产品溶于冷的稀KOH溶液,过滤除杂,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,过滤,用乙醚洗涤。
Ⅵ.重复操作Ⅴ,在真空干燥箱中干燥,得到9.9g产品。
回答下列问题:
-
(1) 仪器a的名称是,a中所盛装的药品是(选填字母序号)。
A.NaCl B.MnO2 C.Na2CO3 D.KMnO4
-
(2) 步骤Ⅰ,检查甲装置气密性的方法是。
-
(3) 乙装置中饱和NaCl溶液的作用是。
-
(4) 步骤Ⅱ,丙中三颈烧瓶内发生反应的离子方程式是。
-
(5) 步骤Ⅲ,丙中生成Na2FeO4的离子方程式是。
-
(6) 步骤Ⅳ中通入N2的目的是。步骤Ⅴ,将粗产品“过滤除杂”,主要目的是除去(填化学式)。
-
(7) 该实验中产品的产率为。
能正确表示下列变化的离子方程式是( )
A . 硫酸铝溶液中加入足量氨水:Al3++4OH-=AlO +2H2O
B . 向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu
C . NH4HCO3溶液中加入过量NaOH溶液:OH-+NH
+2H2O
B . 向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu
C . NH4HCO3溶液中加入过量NaOH溶液:OH-+NH =NH3•H2O
D . 硅酸钠溶液与醋酸溶液混合:SiO
=NH3•H2O
D . 硅酸钠溶液与醋酸溶液混合:SiO +2CH3COOH=H2SiO3↓+2CH3COO-
+2CH3COOH=H2SiO3↓+2CH3COO-
 +2H2O
B . 向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu
C . NH4HCO3溶液中加入过量NaOH溶液:OH-+NH
+2H2O
B . 向CuSO4溶液中加入金属钠:2Na+Cu2+=2Na++Cu
C . NH4HCO3溶液中加入过量NaOH溶液:OH-+NH =NH3•H2O
D . 硅酸钠溶液与醋酸溶液混合:SiO
=NH3•H2O
D . 硅酸钠溶液与醋酸溶液混合:SiO +2CH3COOH=H2SiO3↓+2CH3COO-
+2CH3COOH=H2SiO3↓+2CH3COO-
向铁粉中加入过量稀硫酸,可制备得到硫酸亚铁溶液,下列用来解释事实的方程式中合理的是( )
A . 制备原理:Fe+2H++SO  =FeSO4+H2↑
B . 得到的溶液显酸性的主要原因:H2SO4=2H++SO
=FeSO4+H2↑
B . 得到的溶液显酸性的主要原因:H2SO4=2H++SO  C . 得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3
D . 向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓
C . 得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3
D . 向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓
 =FeSO4+H2↑
B . 得到的溶液显酸性的主要原因:H2SO4=2H++SO
=FeSO4+H2↑
B . 得到的溶液显酸性的主要原因:H2SO4=2H++SO  C . 得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3
D . 向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓
C . 得到的溶液在空气中变质:4Fe2++8OH-+O2+2H2O=4Fe(OH)3
D . 向制备得到的溶液中滴加氢氧化钠溶液只发生反应:Fe2++2OH-=Fe(OH)2↓
下列离子方程式书写正确的是( )
A . 向苯酚钠溶液中通入少量 :2
:2 +CO2+H2O→2
+CO2+H2O→2 +CO
+CO B . 乙酰胺与NaOH溶液加热时反应:
B . 乙酰胺与NaOH溶液加热时反应: C . 铝与NaOH溶液反应:
C . 铝与NaOH溶液反应: D . 氯气与水反应:
D . 氯气与水反应:
 :2
:2 +CO2+H2O→2
+CO2+H2O→2 B . 乙酰胺与NaOH溶液加热时反应:
B . 乙酰胺与NaOH溶液加热时反应: C . 铝与NaOH溶液反应:
C . 铝与NaOH溶液反应: D . 氯气与水反应:
D . 氯气与水反应:
室温下,在由水电离产生的c(OH-)=1.0×10-12mol·L-1的溶液中,一定不能大量共存的离子组是( )
A . F-、Cl-、Na+、K+
B .  、
、 、Fe2+、Mg2+
C . I-、
、Fe2+、Mg2+
C . I-、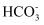 、Ca2+、Ba2+
D .
、Ca2+、Ba2+
D .  、
、 、Na+、K+
、Na+、K+
 、
、 、Fe2+、Mg2+
C . I-、
、Fe2+、Mg2+
C . I-、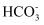 、Ca2+、Ba2+
D .
、Ca2+、Ba2+
D .  、
、 、Na+、K+
、Na+、K+
最近更新



