第2节 氮的循环 知识点题库
下列实验操作正确的是( )
A . 制氨气 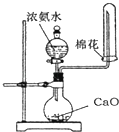 B . 收集CO2或NO
B . 收集CO2或NO 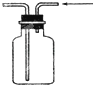 C . 配制稀硫酸
C . 配制稀硫酸 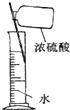 D . 氨气的吸收
D . 氨气的吸收
 B . 收集CO2或NO
B . 收集CO2或NO  C . 配制稀硫酸
C . 配制稀硫酸  D . 氨气的吸收
D . 氨气的吸收
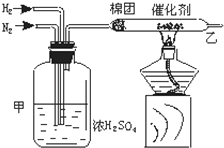
实验室中可用如图所示的装置合成NH3 .
试回答下列问题:
(1)请写出装置甲的三个作用:① 、② 、③ .
(2)从乙导出的气体是 ,检验产物的简单化学方法是 .
下列气体中,对人体无毒害作用的是( )
A . Cl2
B . N2
C . NH3
D . SO2
下列说法正确的是( )
A . 雷雨天气时空气中能生成少量的氮氧化物
B . 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
C . 铵盐化学性质都很稳定
D . O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
固体A的化学式为NH5 , 它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A . NH5中既有共价键又有离子键
B . NH5的电子式为 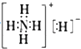 C . 1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D . 它与水反应的离子方程式为NH4++H﹣+H2O═NH3•H2O+H2↑
C . 1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D . 它与水反应的离子方程式为NH4++H﹣+H2O═NH3•H2O+H2↑
下列反应中,硝酸只表现氧化性的是( )
A . 3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O
B . C+4HNO3(浓)  CO2↑+4NO2↑+2H2O
C . Al(OH)3+3HNO3═Al(NO3)3+3H2O
D . 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
CO2↑+4NO2↑+2H2O
C . Al(OH)3+3HNO3═Al(NO3)3+3H2O
D . 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
 CO2↑+4NO2↑+2H2O
C . Al(OH)3+3HNO3═Al(NO3)3+3H2O
D . 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
CO2↑+4NO2↑+2H2O
C . Al(OH)3+3HNO3═Al(NO3)3+3H2O
D . 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
下列对于氨气“喷泉实验”(如图所示)的现象或结论的描述正确的是( )
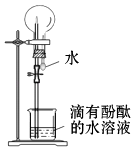
A . 烧杯中的水面会缓缓上升
B . 烧瓶内形成蓝色喷泉
C . 实验证明氨气极易溶于水
D . 实验证明氨气的密度大于空气的密度
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A . 反应剧烈程度:两者相同
B . 消耗HNO3的物质的量:前者多,后者少
C . 反应生成气体的颜色:前者浅,后者深
D . 反应中转移的电子总数:前者多,后者少
用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;
②铜与浓硝酸反应;
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述不正确的是( )
A . 三种途径所消耗铜的质量相等
B . 三种途径所消耗硝酸的物质的量是①>②>③
C . 途径③的制备方法最符合“绿色化学”理念
D . 途径①中被氧化的铜与被还原的硝酸的物质的量之比是3:2
碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
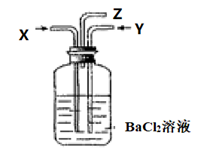
A . 洗气瓶中产生的沉淀是BaCO3
B . 在Z导管出来的气体中无CO2
C . 洗气瓶中产生的沉淀是BaSO3
D . 在Z导管口有红棕色气体
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol·L-1的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是()
A . 硝酸的物质的量浓度为2.6mol·L-1
B . Cu与Cu2O的物质的量之比为2∶1
C . 产生的NO在标准状况下的体积为4.48L
D . Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
将3.2 gCu投入到一定浓度的HNO3 溶液中,恰好完全反应,产生NO2 和NO的混合气体共 0.08 mol。则原溶液中HNO3 的物质的量为( )
A . 0.34 mol
B . 0.38 mol
C . 0.28 mol
D . 0.18 mol
写出下列反应的化学方程式,是离子反应的写离子方程式
-
(1) 工业上制备氨气反应的化学方程式
-
(2) 铜和浓硫酸发生反应的化学方程式
-
(3) 氨气催化氧化生成一氧化氮的化学方程式
-
(4) 工业上制备漂白液发生反应的离子方程式
-
(5) 将亚硫酸钠溶液滴入酸性高锰酸钾溶液中发生反应的离子方程式
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是 ( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验 |
| D | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
A . A
B . B
C . C
D . D
化学与生活、生产联系密切,下列说法错误的是( )
A . 加热纯碱溶液可增强其去污能力
B . 明矾可用作净水剂
C . NH4Cl溶液可作焊接金属的除锈剂
D . 草木灰可与铵态氮肥混合施用
下列说法错误的是( )
A .  可用于自来水消毒
B .
可用于自来水消毒
B . 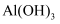 可用作治疗胃酸过多的药物
C .
可用作治疗胃酸过多的药物
C .  不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
 可用于自来水消毒
B .
可用于自来水消毒
B . 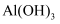 可用作治疗胃酸过多的药物
C .
可用作治疗胃酸过多的药物
C .  不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
不可用做食品防腐剂和肉类食品的发色剂
D . 生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐
-
(1) 用下图所示装置(省略夹持和净化装置)来完成某些气体的制取、收集及尾气处理,表中提供的物质合理的选项是。
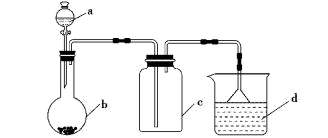
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
KMnO4
Cl2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓硫酸
Na2SO3
SO2
NaOH溶液
-
(2) 实验室里,常用加热固体混合物的方法制取气体NH3 , 请写出其化学方程式:。
下列反应既表现硝酸的氧化性,又表现硝酸的酸性的是( )
A .  B .
B .  C .
C . 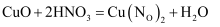 D .
D . 
 B .
B .  C .
C . 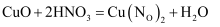 D .
D . 
下列说法正确的是( )
A . CO、NO、 都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的
都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的 胶体有吸附性,因此常用明矾对水进行消毒
C .
胶体有吸附性,因此常用明矾对水进行消毒
C .  、
、 或
或 都会导致酸雨的形成
D . 活性炭、
都会导致酸雨的形成
D . 活性炭、 、
、 都能使品红溶液褪色,原理不同
都能使品红溶液褪色,原理不同
 都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的
都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的 胶体有吸附性,因此常用明矾对水进行消毒
C .
胶体有吸附性,因此常用明矾对水进行消毒
C .  、
、 或
或 都会导致酸雨的形成
D . 活性炭、
都会导致酸雨的形成
D . 活性炭、 、
、 都能使品红溶液褪色,原理不同
都能使品红溶液褪色,原理不同
汽车尾气中的氮氧化物(NOx)是一种大气污染物,严格控制其排放是打好蓝天保卫战的重要工作之一。
-
(1) 氮氧化物造成的环境污染问题主要有(写出一种即可)。
-
(2) 我国自主研发的NO原电池传感器可用于监测汽车尾气中NO含量,其工作原理如图所示。

已知:该装置中以熔融的金属氧化物作电解质,传感器工作时,O2-在电解质中定向移动。
①NiO电极上发生的是(填“氧化”或“还原”)反应。
②传感器工作时,电解质中的O2-向(填“NiO电极”或“Pt电极”)移动。
-
(3) 安装汽车尾气净化装置,可在催化剂作用下将尾气中的有害气体NO、CO转化为无害气体。该反应的化学方程式为。
-
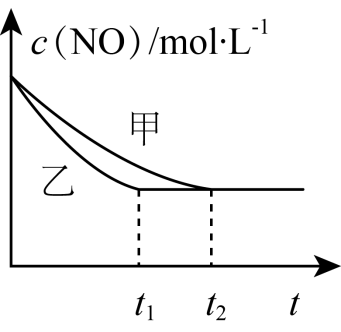
(4) 某同学为了验证温度和催化剂的比表面积对化学反应速率的影响规律,设计了三组实验(如表所示):
实验编号
温度/℃
NO初始浓度/mol·L-1
CO初始浓度/mol·L-1
催化剂的比表面积/m2·g-1
I
280
1.20×10-3
5.80×10-3
82
II
280
1.20×10-3
5.80×10-3
124
III
350
1.20×10-3
a
82
已知:增大催化剂的比表面积可提高反应速率。
①表中a=。
②实验I和实验II中,NO的物质的量浓度c随甲时间t变化的关系如图所示,其中表示实验I的是曲线(填“甲”或“乙”)。
最近更新




