第2节 氮的循环 知识点题库
已知:甲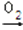 乙
乙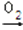 丙
丙 丁,其中丁为强酸,则甲不可能为 ( )
丁,其中丁为强酸,则甲不可能为 ( )
已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )

 CH3Cl+HCl
B . ①可能为Fe+2Fe3+═3Fe2+
C . ②可能为2NO+O2═2NO2
D . ②可能为CO32﹣+H2O+CO2═2HCO3﹣
CH3Cl+HCl
B . ①可能为Fe+2Fe3+═3Fe2+
C . ②可能为2NO+O2═2NO2
D . ②可能为CO32﹣+H2O+CO2═2HCO3﹣

-
(1) 写出反应Ⅲ的化学方程式:
-
(2) 下列有关说法正确的是 (填字母).A . 反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 B . 反应Ⅱ和反应Ⅲ的基本反应类型相同 C . 反应Ⅳ需控制在60﹣70℃,目的之一是减少碳酸氢铵的分解 D . 反应Ⅴ中的副产物氯化铵可用作氮肥
-
(3) (NH4 )2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式:.
-
(4) 很多硫酸厂为回收利用SO2 , 直接用氨水吸收法处理尾气.
①用15.0mL2.0mol•L﹣1氨水吸收标准状况下448mLSO2 , 吸收液中的溶质为
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00mL,则酸性KMnO4溶液中,c(KMnO4)=
-
(5) 氨气用途广泛,可以直接用于燃料电池,如图是用氨水作燃料的燃料电池的工作原理.

氨气燃料电池的电解质溶液最好选择(填“酸性”“碱性”或“中性”)溶液,氮气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是,负极的电极反应式是.

 :先加氯水,再加KSCN,若变红,则有Fe2+
B . 检验NH4+:先加NaOH,加热,用蓝色石蕊试纸检验,若变红,则有NH4+
C . 检验Cl-:先加AgNO3 , 再加HNO3 , 若有白色沉淀,则有Cl-
D . 检验
:先加氯水,再加KSCN,若变红,则有Fe2+
B . 检验NH4+:先加NaOH,加热,用蓝色石蕊试纸检验,若变红,则有NH4+
C . 检验Cl-:先加AgNO3 , 再加HNO3 , 若有白色沉淀,则有Cl-
D . 检验 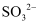 :先加HNO3 , 将生成的气体通入品红,若品红褪色,则有
:先加HNO3 , 将生成的气体通入品红,若品红褪色,则有 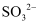

-
(1) 下列有关NH3的说法中,错误的是__________(双选)。A . 工业合成NH3需要在高温高压下进行 B . NH3可用来生产碳铵和尿素等化肥 C . NH3可用浓硫酸或无水氯化钙干燥 D . NH3受热易分解,须置于冷暗处保存
-
(2) NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为mol.L-1。
-
(3) 氨气在氧化炉中所发生反应的化学方程式为。
-
(4) “吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3++CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2 , 则混合气体中NO和NO2的物质的量之比为。
| 选项 | 被检验的物质 | 使用的试剂或方法 | 实验现象 |
| A | Fe3+ | KSCN溶液 | 溶液出现血红色沉淀 |
| B | SO2 | 品红溶液 | 品红溶液褪色,加热不能复原 |
| C | Na+ | 用铂丝蘸取少量溶液在火焰上灼烧 | 透过蓝色钴玻璃看到紫色火焰 |
| D | NH4+ | NaOH溶液、石蕊试纸 | 加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝 |

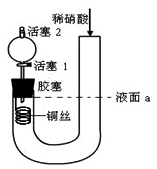
I.称取144.6g样品,灼烧至恒重时(假如只失去结晶水,不发生其他反应),得蒸馏水的质量为64.8g。
II.将上述剩余固体完全溶于水,并将所得溶液分成三等份:
①往其中一份中加入足量的 NaOH 浓溶液并加热,最终得到标准状况下2.24L气体。
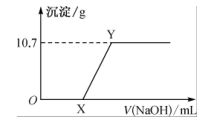
②往第二份中加入稀硫酸,然后向此混合溶液中逐滴加入0.1mol·L-1 NaOH 溶液,滴加过程中产生红褐色沉淀的质量与加入 NaOH 溶液的体积的关系如图所示:
③往第三份中加入足量的0.1mol·L-1 BaCl2溶液,生成不溶于稀硝酸的白色沉淀46.6g
回答下列问题:
-
(1) 操作①中生成气体的离子方程式为。
-
(2) 操作②中OX段反应的离子方程式为 ;XY 段反应的离子方程式为 。
-
(3) 操作③中生成的沉淀为 ,其物质的量为。
-
(4) 铁铵矾的化学式为 。
 分子筛催化剂,
分子筛催化剂,  可脱除燃煤烟气中的NO和
可脱除燃煤烟气中的NO和  ,其反应历程如图所示,下列说法错误的是( )
,其反应历程如图所示,下列说法错误的是( ) 
 B . X是
B . X是  ,Y是
,Y是  C .
C .  是中间产物
D .
是中间产物
D .  属于化合反应
属于化合反应
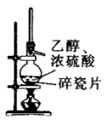
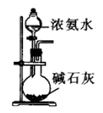
 C . 丙:制备
C . 丙:制备 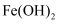 D . 丁:制备氨气
D . 丁:制备氨气
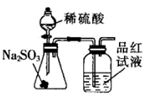
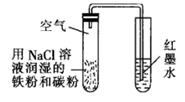
| A | B | C | D |
| | | | |
| 制取 | 验证 | 制取少量 | 检验该条件下铁发生了吸氧腐蚀 |
 (其他产物及反应条件已略去)。回答下列问题:
(其他产物及反应条件已略去)。回答下列问题:
-
(1) 若甲为具有臭鸡蛋气味的有毒气体,乙为淡黄色固体单质;甲和丙反应可生成乙和另一种无色无味的液体,则甲的化学式为,写出甲和丙反应的化学方程式:。
-
(2) 若甲、乙、丙均为化合物,其中甲为有刺激性气味的气体,水溶液呈碱性;丙为红棕色气体。
①实验室检验气体甲的方法为(简述操作、现象及结论)。
②在催化剂的作用下,气体甲可还原乙和丙生成两种无污染的物质。同温、同压下将体积分别为
 、
、  、
、  的甲、乙、丙三种气体混合,在催化剂的作用下充分反应恰好生成两种无污染的物质,则
的甲、乙、丙三种气体混合,在催化剂的作用下充分反应恰好生成两种无污染的物质,则  、
、  、
、  应满足的关系是(用
应满足的关系是(用  、
、  、
、  表示)。
表示)。 -
(3) 若甲为短周期元素组成的一元强碱,丁为无色无味的气体。
①某实验小组设计用澄清石灰水来鉴别乙和丙,该实验(填“能”或“不能”)成功,其原因为。
②写出甲和丙反应的离子方程式:。

 具有漂白性
具有漂白性



