第3иҠӮ зЎ«зҡ„иҪ¬еҢ– зҹҘиҜҶзӮ№йўҳеә“
еәҸеҸ· | в‘ | в‘Ў | в‘ў | в‘Ј | в‘Ө |
з”І | CO2 | HCl | CO2 | NO2 | CO2 |
д№ҷ | SO2 | CO2 | SO2 | SO2 | NH3 |
дёҷ | зҹізҒ°ж°ҙ | зҹізҒ°ж°ҙ | BaпјҲNO3пјү2 | BaCl2 | CaCl2 |
пјҲВ пјү


-
пјҲ1пјү жө“зЎ«й…ёдёҺй“ңзүҮеҸҚеә”зҡ„ж–№зЁӢејҸдёәпјҺ
-
пјҲ2пјү еҸҚеә”иҝҮзЁӢдёӯпјҢз”Ідёӯзҡ„зҺ°иұЎжҳҜпјҺ
-
пјҲ3пјү дёӢеҲ—иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜ В В В В В В пјҺA . иҜҘеҸҚеә”дёӯжө“зЎ«й…ёиЎЁзҺ°й…ёжҖ§гҖҒж°§еҢ–жҖ§гҖҒеҗёж°ҙжҖ§ B . иҜ•з®Ўд№ҷдёӯеҗ«жңүзўұж¶Ізҡ„жЈүиҠұпјҢе…¶дҪңз”ЁжҳҜеҗёж”¶иҝҮйҮҸзҡ„SO2 пјҢ йҳІжӯўзҺҜеўғжұЎжҹ“ C . еҗ«0.02molжә¶иҙЁзҡ„жө“зЎ«й…ёдёҺи¶ійҮҸзҡ„й“ңзүҮеҸҚеә”пјҢиғҪ收йӣҶеҲ°224mLзҡ„SO2пјҲж ҮеҮҶзҠ¶еҶөпјү D . еҸҚеә”дёҖж®өж—¶й—ҙеҗҺпјҢе°Ҷж°ҙзј“ж…ўеҖ’е…ҘиҜ•з®Ўз”ІдёӯпјҢжә¶ж¶Іжҳҫи“қиүІпјҺ

-
пјҲ1пјү иЈ…зҪ®Aдёӯзӣӣж”ҫдәҡзЎ«й…ёй’ зҡ„д»ӘеҷЁеҗҚз§°жҳҜпјҢе…¶дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјӣ
-
пјҲ2пјү е®һйӘҢиҝҮзЁӢдёӯпјҢиЈ…зҪ®BгҖҒCдёӯеҸ‘з”ҹзҡ„зҺ°иұЎеҲҶеҲ«жҳҜгҖҒпјҢиҝҷдәӣзҺ°иұЎеҲҶеҲ«иҜҙжҳҺSO2е…·жңүзҡ„жҖ§иҙЁжҳҜе’ҢпјӣиЈ…зҪ®BдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјӣ
-
пјҲ3пјү иЈ…зҪ®Dзҡ„зӣ®зҡ„жҳҜжҺўз©¶SO2дёҺе“ҒзәўдҪңз”Ёзҡ„еҸҜйҖҶжҖ§пјҢиҜ·еҶҷеҮәе®һйӘҢж“ҚдҪңеҸҠзҺ°иұЎпјӣ
-
пјҲ4пјү е°ҫж°”еҸҜйҮҮз”Ёжә¶ж¶Іеҗёж”¶пјҺ
 пјҡе…ҲеҠ ж°Ҝж°ҙпјҢеҶҚеҠ KSCNпјҢиӢҘеҸҳзәўпјҢеҲҷжңүFe2+
B . жЈҖйӘҢNH4+пјҡе…ҲеҠ NaOHпјҢеҠ зғӯпјҢз”Ёи“қиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢпјҢиӢҘеҸҳзәўпјҢеҲҷжңүNH4+
C . жЈҖйӘҢCl-пјҡе…ҲеҠ AgNO3 пјҢ еҶҚеҠ HNO3 пјҢ иӢҘжңүзҷҪиүІжІүж·ҖпјҢеҲҷжңүCl-
D . жЈҖйӘҢ
пјҡе…ҲеҠ ж°Ҝж°ҙпјҢеҶҚеҠ KSCNпјҢиӢҘеҸҳзәўпјҢеҲҷжңүFe2+
B . жЈҖйӘҢNH4+пјҡе…ҲеҠ NaOHпјҢеҠ зғӯпјҢз”Ёи“қиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢпјҢиӢҘеҸҳзәўпјҢеҲҷжңүNH4+
C . жЈҖйӘҢCl-пјҡе…ҲеҠ AgNO3 пјҢ еҶҚеҠ HNO3 пјҢ иӢҘжңүзҷҪиүІжІүж·ҖпјҢеҲҷжңүCl-
D . жЈҖйӘҢ 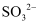 пјҡе…ҲеҠ HNO3 пјҢ е°Ҷз”ҹжҲҗзҡ„ж°”дҪ“йҖҡе…Ҙе“ҒзәўпјҢиӢҘе“ҒзәўиӨӘиүІпјҢеҲҷжңү
пјҡе…ҲеҠ HNO3 пјҢ е°Ҷз”ҹжҲҗзҡ„ж°”дҪ“йҖҡе…Ҙе“ҒзәўпјҢиӢҘе“ҒзәўиӨӘиүІпјҢеҲҷжңү 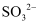
дёӢеҲ—еҗ„з»„зү©иҙЁпјҡв‘ Cuе’ҢHNO3жә¶ж¶І в‘ЎCuе’ҢFeCl3жә¶ж¶І в‘ўZnдёҺH2SO4жә¶ж¶І в‘ЈFeе’ҢHCl
жә¶ж¶Із”ұдәҺжө“еәҰдёҚеҗҢиҖҢиғҪеҸ‘з”ҹдёҚеҗҢж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жҳҜ( )
| еҸҚеә”е®Ө | иҪҪж°” | еҗёж”¶ж¶І | SO42-еҗ«йҮҸ | ж•°жҚ®еҲҶжһҗ |
| в‘ | n2 | и’ёйҰҸж°ҙ | a | i.bвүҲd>aвүҲc ii. иӢҘиө·е§ӢдёҚйҖҡе…ҘNO2 пјҢ еҲҷжңҖз»ҲжөӢ дёҚеҲ°SO42- |
| в‘Ў | 3%ж°Ёж°ҙ | b | ||
| в‘ў | з©әж°” | и’ёйҰҸж°ҙ | c | |
| в‘Ј | 3%ж°Ёж°ҙ | d |

-
пјҲ1пјү еҶҷеҮәBaSO4зҡ„еҗҚз§°пјҡпјҢеҶҷеҮәд№ҷзғ·зҡ„з»“жһ„з®ҖејҸпјҡгҖӮ
-
пјҲ2пјү еҶҷеҮәзўідёҺжө“зЎ«й…ёеҠ зғӯжқЎд»¶дёӢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡгҖӮ
 MgCl2(aq)
MgCl2(aq)  Mg
B . S
Mg
B . S  SO3
SO3  H2SO4
C . зІ—зЎ…
H2SO4
C . зІ—зЎ…  SiCl4
SiCl4  Si
D . Fe
Si
D . Fe  FeCl2
FeCl2  Fe(OH)2
Fe(OH)2
 зҡ„
зҡ„  жә¶ж¶ІдёӯпјҢжІЎжңүжІүж·Җдә§з”ҹзҡ„жҳҜпјҲ пјү
жә¶ж¶ІдёӯпјҢжІЎжңүжІүж·Җдә§з”ҹзҡ„жҳҜпјҲ пјү
 B . HCl
C .
B . HCl
C .  D .
D . 
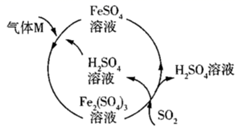
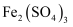 зҡ„
B . ж°”дҪ“MжҳҜ
зҡ„
B . ж°”дҪ“MжҳҜ  C . ж°”дҪ“MеҸӮеҠ зҡ„еҸҚеә”дёҚжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”
D .
C . ж°”дҪ“MеҸӮеҠ зҡ„еҸҚеә”дёҚжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”
D .  еҸӮеҠ еҸҚеә”ж—¶ж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜ1пјҡ1
еҸӮеҠ еҸҚеә”ж—¶ж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜ1пјҡ1
 D . жө“зЎ«й…ё
D . жө“зЎ«й…ё
 иғҪеҜјиҮҙвҖңе…үеҢ–еӯҰзғҹйӣҫвҖқзҡ„еҪўжҲҗ
B . жө“зЎқй…ёеҸҜз”Ёй“қж§ҪиҪҰиҝҗиҫ“
C . зҹізҒ°зҹіеңЁй«ҳжё©дёӢеҸҜз”ЁдәҺж¶ҲйҷӨзҮғз…Өзғҹж°”дёӯзҡ„
иғҪеҜјиҮҙвҖңе…үеҢ–еӯҰзғҹйӣҫвҖқзҡ„еҪўжҲҗ
B . жө“зЎқй…ёеҸҜз”Ёй“қж§ҪиҪҰиҝҗиҫ“
C . зҹізҒ°зҹіеңЁй«ҳжё©дёӢеҸҜз”ЁдәҺж¶ҲйҷӨзҮғз…Өзғҹж°”дёӯзҡ„  D . ж°®ж°”еҢ–еӯҰжҖ§иҙЁзЁіе®ҡпјҢеҸҜе°ҶзӮҪзғӯзҡ„й•ҒзІүж”ҫеңЁж°®ж°”дёӯеҶ·еҚҙ
D . ж°®ж°”еҢ–еӯҰжҖ§иҙЁзЁіе®ҡпјҢеҸҜе°ҶзӮҪзғӯзҡ„й•ҒзІүж”ҫеңЁж°®ж°”дёӯеҶ·еҚҙ
| йҖүйЎ№ | е®һйӘҢзӣ®зҡ„ | е®һйӘҢж–№жЎҲ |
| A | йҷӨеҺ»Al2O3дёӯзҡ„Fe2O3 | еҗ‘еӣәдҪ“дёӯе…ҲеҠ е…ҘиҝҮйҮҸNaOHжә¶ж¶ІпјҢиҝҮж»ӨеҗҺеҗ‘ж»Өж¶ІдёӯеҠ е…ҘиҝҮйҮҸзӣҗй…ё |
| B | иҜҒжҳҺжә¶ж¶Ідёӯж— NH | еҗ‘жҹҗжә¶ж¶Ідёӯж»ҙеҠ е°‘йҮҸзЁҖNaOHжә¶ж¶ІпјҢе°Ҷж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёзҪ®дәҺиҜ•з®ЎеҸЈиҜ•зәёдёҚеҸҳи“қ |
| C | иҜҒжҳҺдәҢж°§еҢ–зЎ«е…·жңүиҝҳеҺҹжҖ§ | е°ҶдәҢж°§еҢ–зЎ«йҖҡе…ҘBa(NO3)2жә¶ж¶ІдёӯпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗ |
| D | йӘҢиҜҒпјҡKsp(AgI)<Ksp(AgCl) | еҗ‘зӣӣжңү1mL0.1molВ·L-1AgNO3жә¶ж¶Ізҡ„иҜ•з®Ўдёӯж»ҙеҠ 2ж»ҙ0.1molВ·L-1NaClжә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢеҗ‘е…¶дёӯ继з»ӯж»ҙеҠ 0.1molВ·L-1KIжә¶ж¶ІпјҢжңүй»„иүІжІүж·Җдә§з”ҹ |

-
пјҲ1пјү еӣҫдёӯвҖңXвҖқд»ЈиЎЁзҡ„зү©иҙЁзұ»еҲ«жҳҜпјӣ
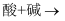 пјӣYиҪ¬еҢ–дёәXдҪ“зҺ°дәҶYзҡ„жҖ§гҖӮ
пјӣYиҪ¬еҢ–дёәXдҪ“зҺ°дәҶYзҡ„жҖ§гҖӮ
-
пјҲ2пјү
 жҳҜйҮҚиҰҒзҡ„еӨ§ж°”жұЎжҹ“зү©пјҢдјҡеҜјиҮҙвҖңй…ёйӣЁвҖқгҖӮ
жҳҜйҮҚиҰҒзҡ„еӨ§ж°”жұЎжҹ“зү©пјҢдјҡеҜјиҮҙвҖңй…ёйӣЁвҖқгҖӮ дә§з”ҹзЎ«й…ёеһӢй…ёйӣЁжңүдёӨжқЎйҖ”еҫ„пјҡйҖ”еҫ„дёҖжҳҜ
дә§з”ҹзЎ«й…ёеһӢй…ёйӣЁжңүдёӨжқЎйҖ”еҫ„пјҡйҖ”еҫ„дёҖжҳҜ
 пјӣеҸҰдёҖйҖ”еҫ„жҳҜпјҡ
пјӣеҸҰдёҖйҖ”еҫ„жҳҜпјҡ гҖӮ
гҖӮ
-
пјҲ3пјү е°ҶиЈ…жңү
 зҡ„иҜ•з®ЎеҖ’з«ӢеңЁж°ҙж§ҪдёӯпјҢеҸҜи§ӮеҜҹеҲ°гҖӮеҸ–еҮәиҜ•з®Ўдёӯзҡ„жә¶ж¶ІпјҢеҲҶеҲ«иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ
зҡ„иҜ•з®ЎеҖ’з«ӢеңЁж°ҙж§ҪдёӯпјҢеҸҜи§ӮеҜҹеҲ°гҖӮеҸ–еҮәиҜ•з®Ўдёӯзҡ„жә¶ж¶ІпјҢеҲҶеҲ«иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ
в‘ ж»ҙеҠ е“Ғзәўжә¶ж¶ІжҢҜиҚЎпјҢи§ӮеҜҹеҲ°зәўиүІиӨӘеҺ»пјҢиҜҙжҳҺ
 е…·жңүжҖ§гҖӮ
е…·жңүжҖ§гҖӮв‘Ўж»ҙеҠ
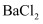 жә¶ж¶ІпјҢж— жҳҺжҳҫзҺ°иұЎпјҢеҶҚж»ҙе…Ҙ
жә¶ж¶ІпјҢж— жҳҺжҳҫзҺ°иұЎпјҢеҶҚж»ҙе…Ҙ жә¶ж¶ІеҗҺеҮәзҺ°зҷҪиүІжІүж·ҖгҖӮеҮәзҺ°зҷҪиүІжІүж·Җзҡ„еҺҹеӣ жҳҜгҖӮ
жә¶ж¶ІеҗҺеҮәзҺ°зҷҪиүІжІүж·ҖгҖӮеҮәзҺ°зҷҪиүІжІүж·Җзҡ„еҺҹеӣ жҳҜгҖӮ -
пјҲ4пјү ж №жҚ®
 зҡ„жҖ§иҙЁжҸҗеҮәдёҖз§ҚзҮғз…Өи„ұзЎ«зҡ„ж–№жі•гҖӮ
зҡ„жҖ§иҙЁжҸҗеҮәдёҖз§ҚзҮғз…Өи„ұзЎ«зҡ„ж–№жі•гҖӮ

-
пјҲ1пјү Xзҡ„еҢ–еӯҰејҸжҳҜпјӣд»ҺзЎ«е…ғзҙ зҡ„еҢ–еҗҲд»·еҸҳеҢ–и§’еәҰеҲҶжһҗпјҢеӣҫдёӯYдёҺH2O2зҡ„еҸҚеә”ж—¶пјҢYдҪ“зҺ°дәҶжҖ§(еЎ«вҖңж°§еҢ–вҖқжҲ–вҖңиҝҳеҺҹвҖқ)пјӣеҶҷеҮәжЈҖйӘҢзү©иҙЁYзҡ„дёҖз§Қж–№жі•жҳҜгҖӮ
-
пјҲ2пјү Zзҡ„жө“жә¶ж¶ІдёҺй“ңеҚ•иҙЁеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜд»ҘеҸ‘з”ҹеҢ–еӯҰеҸҚеә”пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү Na2S2O3жҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷгҖӮд»Һж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„и§’еәҰеҲҶжһҗпјҢдёӢеҲ—еҲ¶еӨҮNa2S2O3зҡ„ж–№жЎҲзҗҶи®әдёҠеҸҜиЎҢзҡ„жҳҜ____(еЎ«еӯ—жҜҚ)гҖӮA . Na2S+S B . Na2SO3+S C . SO2+Na2SO4 D . Na2SO3+Na2SO4
-
пјҲ4пјү е·ІзҹҘNa2SO3иғҪиў«K2Cr2O7ж°§еҢ–дёәNa2SO4 пјҢ еҲҷ24mL0.05molВ·L-1зҡ„Na2SO3жә¶ж¶ІдёҺ20mL0.02molВ·L-1зҡ„K2Cr2O7жә¶ж¶ІжҒ°еҘҪеҸҚеә”ж—¶пјҢCrе…ғзҙ еңЁиҝҳеҺҹдә§зү©дёӯзҡ„еҢ–еҗҲд»·дёәгҖӮ




